

Osteonecrosis maxilar en síndrome antifosfolipídico
Revisión de la literatura a propósito de un caso
Maxillary osteonecrosis in antiphospholipidic syndrome.
Literature review and case report
Recibido: 26-04-2021
Aceptado: 30-03-2022
Publicado: 31-03-2022
Revista MetroCiencia
Volumen 30, Número 1, 2022
Editorial Hospital Metropolitano
Marco Cedillo Bailón1, Fernando Sandoval Vernimmen1, Fernando Sandoval Portilla1
El síndrome antifosfolipídico (SAF) fue descrito por primera vez en 1983 por Hughes y se caracteriza por ser un trastorno autoinmune sistémico que genera trombosis venosa o arterial de manera recurrente, así como morbilidad obstétrica debido a la producción persistente de anticuerpos antifosfolipídicos (aFL). La trombofilia puede aparecer en diferentes sistemas y órganos, incluyendo el tejido óseo. Esta afección puede desarrollarse especialmente en pacientes que acumulan factores de riesgo como lo son enfermedades autoinmunes, corticoterapia, exposición a trauma local e infecciones crónicas. En el presente artículo se realizó una revisión de la literatura referente al SAF y se presenta un caso de osteonecrosis maxilar luego de un procedimiento de extracción dental en un paciente con SAF primario. Además, se expone la osteonecrosis como una posible complicación de esta enfermedad para lo cual se plantean algunas alternativas de tratamiento.
Palabra Claves: síndrome antifosfolipídico, anticuerpos antifosfolipídicos, trombosis, osteonecrosis, cirugía bucal.
Antiphospholipid síndrome (SAF) was first described in 1983 by Hughes and is characterized by being a systemic autoimmune disorder that generates recurrent venous or arterial thrombosis, as well as obstetric morbility due to the persistent production of antiphospholipid antibodies. Thrombophilia can appear in different systems and organs, including bone tissue. This condition can develop especially in patients who accumulate risk factors such as autoimmune diseases, corticosteroid therapy, or exposure to local trauma and chronic infections. In this article, a review of the literature regarding SAF was performed and a case of maxillary osteonecrosis after a dental extraction procedure in a patient with primary SAF is presented. In addition, osteonecrosis is exposed as a possible complication of this disease, for which some treatment alternatives are proposed.
Keywords: antiphospholipid syndrome, antiphospholipid antibodies, thrombosis, osteonecrosis, oral surgery.
Marco Cedillo Bailón
![]() https://orcid.org/0000-0002-0110-5731
https://orcid.org/0000-0002-0110-5731
Fernando Sandoval Vernimmen
![]() https://orcid.org/0000-0002-4345-2408
https://orcid.org/0000-0002-4345-2408
Fernando Sandoval Portilla
![]()
 |
Este artículo está bajo una licencia de Creative Commons de tipo Reconocimiento – No comercial – Sin obras derivadas 4.0 International. |
*Correspondencia: marocedillob@hotmail.com
El síndrome antifosfolipídico (SAF) tiene una incidencia de 5 casos por cada 1000000 al año con una prevalencia que oscila de 40 a 50 casos por 100000 habitantes. Se trata de un desorden autoinmune caracterizado por eventos trombóticos o complicaciones gestacionales acompañados de títulos elevados de anticuerpos antifosfolipídicos (aFL)1-4.
El acúmulo de estos anticuerpos lleva a la interrupción de la vía antitrombótica de la proteína C causando una reducción de la inhibición de la cascada de coagulación. Así mismo, los aFL enlazan y promueven la agregación plaquetaria, lo cual además de producir un estado trombofílico también puede generar trombocitopenia3-6. Como consecuencia, la oclusión de pequeños vasos puede ocurrir y afectar la piel, retina, vasos cerebrales, renales, pulmonares, cardiacos y óseos7,8. La prevalencia de varias complicaciones fue estimada en un estudio de cohorte de 1000 pacientes llevada a cabo en 2002 por Cervera (Tabla 1)3 donde la osteonecrosis aparece como un evento posible dada la fisiopatogenia del SAF, siendo más frecuente cuando existen factores de riesgo asociados como: trauma, infecciones, livedo reticularis, alcoholismo, tabaquismo, administración de bifosfonatos o corticoides6,10,11. Por otro lado, tomando en consideración que estos pacientes con frecuencia están anticoagulados, es posible también encontrar eventos de sangrado que pueden requerir un cuidado especial5,7,11,12.
El diagnóstico de esta enfermedad con frecuencia viene luego de alguna complicación clínica. En este punto, los criterios Sapporo son una valiosa herramienta (Tabla 2)7,9,13. Finalmente, su manejo inicia de manera preventiva con dosis bajas de aspirina en pacientes asintomáticos y con heparina de bajo peso molecular para el tratamiento de eventos trombóticos agudos. Otros prefieren la warfarina permitiendo controlar el INR, mismo que debe ser mantenido entre 3.0 y 4.01,2,5,7. En cuanto al aspecto quirúrgico, se recomienda evitar la suspensión del tratamiento antitrombótico con el objetivo de prevenir complicaciones isquémicas. Además, es imperativo siempre suturar las heridas junto con hemostáticos absorbibles y minuciosos cuidados postoperatorios1,7,9.
Tabla 1. Incidencia de manifestaciones clínicas en 1000 paciente con síndrome antifosfolipídico.
| Manifestación | % |
| Trombosis venosa profunda | 3,17 |
| Trombocitopenia | 29,9 |
| Livedo reticularis |
20,4 |
| Infarto |
13,1 |
| Tromboflebitis superficial | 9,1 |
| Embolismo pulmonar | 9,0 |
| Pérdida fetal | 8,3 |
| Ataque isquémico transitorio |
7 |
| Anemia hemolítica | 6,6 |
| Ulceras en piel |
3,9 |
| Epilepsia |
3,4 |
| Lesiones pseudovasculares en piel |
2,6 |
| Infarto de miocardio | 2,8 |
| Amaurosis fugax |
2,8 |
| Osteonecrosis sintomática | 2,4 |
Fuente: Okuyama K, Naruse T, Yutori H, Yanamoto S, Umeda M3
Tabla 2. Criterios Sapporo para el diagnóstico del síndrome antifosfolipídico.
|
Los criterios clínicos:
|
|
Los criterios de laboratorio:
|
|
* La suma de al menos un criterio clínico más un criterio de laboratorio bastan para determinar la enfermedad. |
Fuente: Miyakis S, Lockshin MD13
Se presenta el caso de un paciente, sexo masculino, de 36 años; en su historia clínica refiere SAF primario (sin relación con otra enfermedad sistémica) diagnosticado luego de una estenosis de riñón derecho; además, según reporte oftalmológico presenta palidez del disco óptico por isquemia en la papila óptica. Al momento de la evaluación acude bajo tratamiento con ácido acetilsalicílico 100 mg cada 24 horas. No presenta más antecedente personales ni familiares de importancia. El paciente es valorado en la consulta privada por presentar necrosis pulpar y absceso apical crónico de canino maxilar izquierdo además de perdida ósea con exposición de estrías del implante del primer premolar maxilar izquierdo. Se decide iniciar con antibioticoterapia con ampicilina + sulbactam para luego realizar extracción del canino seguido de curetaje y descontaminación con tetraciclina para posterior injerto óseo por mesial y apical del implante remanente. El procedimiento se realizó sin retiro de terapia antiagregante por presencia de SAF y riesgo de trombosis. En la cita de control luego de una semana se evidencia exposición y pérdida del injerto junto con necrosis de encía adherida desde incisivo lateral hasta premolar de zona intervenida. Se realizan lavados profusos y se añade metronidazol 500 mg al esquema antibiótico de ampicilina con sulbactam, ambos de manera intravenosa bajo supervisión médica en domicilio del paciente. Al control al siguiente día se evidencia un aumento de la necrosis en el vestíbulo distal por lo que se vuelve a realizar lavados y se coloca apósito con gasa yodoformada, también se remite a cámara de oxígeno hiperbárico (20 sesiones de oxígeno al 100% a 2,4 atmosferas de presión) (Figura 1). Luego de dos días se realizó un nuevo control donde se pudo ver una ligera mejoría con una leve formación de tejido de granulación, se mantienen los mismos cuidados locales y generales. A los 5 días ya se evidenció una franca mejoría con formación de tejido de granulación y reducción de la sintomatología del paciente (Figura 2). Un último control clínico se realizó luego de un mes del inicio de la osteonecrosis donde existió ya una total cobertura de mucosa, el paciente no refería más molestias clínicas (Figura 3). Concluimos que dada la evolución del paciente y el antecedente de SAF, el diagnostico fue de osteonecrosis secundaria a esta enfermedad, predispuesta por el trauma local y la infección previa del paciente.
Figura 1-3. 1. Control a los 8 días postquirúrgico. 2. Formación de tejido de granulación 5 días después del primer control. 3. Control 1 mes después del inicio de la osteonecrosis.
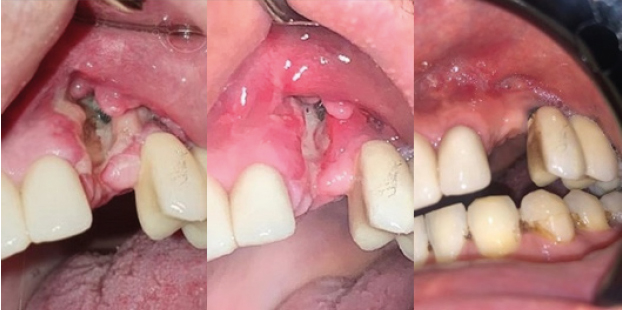
Fuente: Los autores.
Los pacientes con SAF padecen un riesgo significativamente mayor de presentar complicaciones trombóticas postoperatorias debido a la hipercoagulabilidad9. En el estudio de Cervera con una cohorte de 1000 pacientes con SAF se pudo evidenciar que la prevalencia de anticuerpos anticardiolipina estuvo presente en 879 pacientes (87,9%), anticuerpo lúpico en 536 pacientes (53,6%). Además, también se encontraron otros anticuerpos diferentes a los antifosfolipídicos; como los anticuerpos antinucleares en el 59,7 % de casos, ADN anti-bicatenario en el 29,2 % de casos, anticuerpos anti Ro (14%) y factor reumatoide en el 7,8 % así como otros autoanticuerpos en menor porcentaje3. En cuanto a las manifestaciones clínicas, la osteonecrosis es una complicación que puede ocurrir como se demostró en nuestro caso y en algunos otros informes como el de Gruppo et al., quien documentó la presencia de anticuerpos anticardiolipina en 18 (33 %) de 55 pacientes con osteonecrosis alveolar idiopática de la mandíbula12. Así mismo, Weber y colegas estudiaron a 108 pacientes con SAF desde 1987 hasta 1996. Ellos reportan que la osteonecrosis sintomática se presentó en 7 (10 %) de los 69 pacientes con SAF secundario (Asociado a otra enfermedad sistémica), pero en ningún caso de los 22 pacientes con SAF Primario9. La correlación entre osteonecrosis y la presencia de aFL en pacientes con lupus eritematoso sistémico (LES) fue presentada inicialmente por Asherson en 1985. El mismo en 1993 indico que un 73% de los pacientes con LES y osteonecrosis sintomática presentaban también aFL positivos9,14. Por otro lado, Asherson et al reconoció la presencia de osteonecrosis sintomática en solo 2 de 70 pacientes con SAF primario, concluyendo que en estos casos su presentación es infrecuente y esporádica, más aún en ausencia de corticoterapia como sí ocurrió en el caso presentado8.
En cuanto al manejo de la enfermedad; la primera línea tanto profiláctica como terapéutica consiste en anticoagulantes, corticoides y cuidados hemostáticos de la herida quirúrgica; la plasmaféresis e inmunoglobulina intravenosa puede usarse como una segunda línea de tratamiento sistémico. Otras terapias como agentes antihiperlipidémicos tienen resultados cuestionados. Así mismo, el rituximab ha sido postulado como una modalidad alternativa; a pesar de tener estudios limitados a pequeñas series de casos, su aplicación ha demostrado buenos resultados en el manejo de osteonecrosis secundaria a SAF4,7. El principio de la aplicación de estos fármacos autoinmunes está dado por la necesidad de eliminar los aFL de la circulación y detener su producción favoreciendo la resolución clínica4. Finalmente, la modalidad de tratamiento del presente caso fue llevada con antibioticoterapia, cuidados locales y aplicación de oxígeno hiperbárico. Esto último con la intención de conseguir mayores gradientes de oxígeno que permitan la migración de macrófagos secretores de varias citoquinas incluyendo el factor de crecimiento endotelial estimulante de la angiogénesis y la fibroplasia; los resultados fueron satisfactorios. Sin embargo, luego de la presente revisión pensamos que el manejo puede ser optimizado primeramente con un mejor tratamiento anticoagulante profiláctico y, en segundo lugar, con un mejor control de la enfermedad; teniendo también en cuenta las nuevas alternativas con fármacos autoinmunes4,15.
El punto clave preoperatorio es realizar un correcto diagnóstico e interpretación de la enfermedad donde un historial médico completo es crucial; destacando factores de riesgo como enfermedades autoinmunes, infecciones o uso de corticoides. El cirujano debe tener en cuenta que la osteonecrosis puede ocurrir, aunque existen pocos reportes en la literatura de hecho la osteonecrosis puede representar una característica clínica adicional del SAF ya que su fisiopatología justifica su aparición. Por último, es importante conocer los protocolos en cirugía oral y maxilofacial que permitan un manejo más seguro de estos pacientes previniendo complicaciones como la osteonecrosis o hemorragias. El tratamiento anticoagulante no debe ser retirado y siempre se deben seguir cuidados para el control de la hemostasia además de un seguimiento cercano del paciente.
Contribución de los autores
Marco Cedillo conceptualizó y diseñó los datos, los recopiló, analizó e interpretó los datos, redactó el artículo y revisó críticamente el artículo.
Fernando Sandoval Vernimmen analizó e interpretó los datos, revisó críticamente el artículo, aportó su versión final y aporte con datos anonimizados del paciente.
Fernando Sandoval Portilla analizó e interpretó los datos y revisó críticamente el artículo.
Conflicto de intereses
Los autores declararon no tener ningún conflicto de interés personal, financiero, intelectual, económico y de interés corporativo con el Hospital Metropolitano y los miembros de la revista MetroCiencia.
Financiación
Este estudio no tiene financiamiento.
CITAR ESTE ARTÍCULO:
Cedillo Bailón M, Sandoval Vernimmen F, Sandoval Portilla F. Osteonecrosis maxilar en síndrome antifosfolipidico. Revisión de la literatura a propósito de un caso. Metro Ciencia [Internet]. 30 de marzo de 2022; 30(1):128-134. https://doi.org/10.47464/MetroCiencia/vol30/1/2022/128-134
MetroCiencia VOL. 30 Nº 1 (2022)