

Editorial: Hospital Metropolitano
ISSN (impreso) 1390-2989 - ISSN (electrónico)2737-6303
Edición: Vol. 29 Nº 3 (2021) Julio - Septiembre
DOI: https://doi.org/10.47464/MetroCiencia/vol29/3/2021/11-17
URL: https://revistametrociencia.com.ec/index.php/revista/article/view/202
Pág: 11-17
Gabriela Santafé Troncoso1  , Freud Cáceres Aucatoma2
, Freud Cáceres Aucatoma2  , Shirley Morán Arias 3
, Shirley Morán Arias 3  , Joanna Acebo Arcentales 4
, Joanna Acebo Arcentales 4 
Médico Residente del Departamento de Pediatría, Hospital Metropolitano. Quito-Ecuador1
Facultad Medicina, Pontificia Universidad Católica del Ecuador2
Médico Pediatra, Jefe del Departamento de Pediatría, Hospital Metropolitano. Quito-Ecuador3
Médico Infectóloga Pediatra, Hospital Metropolitano. Quito-Ecuador4
Introducción: La pandemia por COVID 19 en Ecuador fue declarada en marzo del 2020. Desde esa fecha existió un aumento exponencial de la enfermedad. Pero los casos en la edad pediátrica a nivel mundial están reportados como menos frecuentes, sin ser Ecuador la excepción pues hasta marzo 2021 reportó que el 5,4% corresponde a niños. Métodos: Se realizó un estudio transversal. Los datos fueron recopilados de la historia clínica única del sistema GEMA. Las variables de estudio fueron: demográficas, clínicas, pruebas diagnósticas, la estancia hospitalaria y el tratamiento. Para el análisis descriptivo se utilizó porcentajes y mediana; para establecer diferencias significativas se aplicó la prueba Chi cuadrado. Se consideró un resultado significativo una p <0,05. Resultados: Se estudió un total de 19 niños, con predominio de la enfermedad en el sexo femenino y en lactantes menores. Los síntomas más frecuentes fueron: hiporexia, fiebre y síntomas respiratorios. Los estudios complementarios que se realizaron fueron biomarcadores de inflamación al 57,9% de los niños, hemograma al 100% y radiografía de tórax en el 89.5% de casos. La estancia media de hospitalización fue de 3 días. El manejo fue de soporte (oxigeno, antitérmico), terapia respiratoria inhalada, corticoide sistémico y antibioticoterapia. Conclusiones: El estudio demostró que existió una descripción similar a la epidemiología mundial por COVID-19 en cuanto a sintomatología. En los estudios de laboratorio se encontró leucopenia y linfopenia; los biomarcadores de inflamación alterados fueron el dímero D, ferritina, IL-6 y LDH. La evolución fue favorable sin requerimiento de terapia intensiva y con mortalidad nula.
Palabras Claves: COVID-19, coronavirus, niños, pediatría, Ecuador, pandemia.
Introduction: The COVID-19 pandemic in Ecuador was declared in March 2020. Since that date, there has been an exponential increase in the disease. But cases in pediatric age worldwide are reported as less frequent, without being Ecuador the exception. Until March 2021, 5,4% of cases correspond to children. Methods: A transversal analysis was applied in this research. Data was collected from the clinical records of the GEMA system. The study variables were: demographics, clinics, diagnosis tests, hospitalization length, and treatment. The descriptive analysis used percentage and median. To identify significant differences, the Chi-square test was applied. It was considered a significative result p<0,05. Results: In total, 19 children were included in this study. Female and minor infants were the most frequently affected by this disease. The most common symptoms were: fever, hyporexia and respiratory symptoms. The complementary studies were performed: biomarkers of inflammation in 57.9% of the children, complete blood count in all children and chest radiography was performed in 89.5% of cases. The average length of stay in the hospital was three days. The treatment was support measures (oxygen support, antipyretic) and inhaled respiratory therapy, systemic corticosteroid, antibiotic therapy, and zzithromycin. Conclusions: The study showed that the studied cases had a similar description to the worldwide epidemiology of COVID-19 in children in terms of symptoms. In the laboratory evaluation, leukopenia and lymphopenia were found; the inflammatory biomarkers of altered severity were D-dimer, ferritin, IL-6 and LDH. The evolution was favorable without the need for intensive care therapy and with zero mortality.
Keywords: COVID-19, coronavirus, children, pediatrics, Ecuador, pandemic.
| Gabriela Santafé Troncoso: | https://orcid.org/0000-0001-5506-5731 |
| Freud Cáceres Aucatoma: | https://orcid.org/0000-0001-6177-3531 |
| Shirley Morán Arias: | https://orcid.org/0000-0003-0893-1566 |
| Joanna Acebo Arcentales: | https://orcid.org/0000-0002-3446-9558 |
| Correspondencia: | Gabriela Santafé Troncoso |
| e-mail: | santafe10051989@gmail.com |
INTRODUCCIÓN
La pandemia por COVID-19 en Ecuador fue declarada en marzo del 2020. A partir de esa fecha existió un aumento exponencial de la enfermedad. Pero los casos en la edad pediátrica a nivel mundial están reportados como menos frecuentes, sin ser Ecuador la excepción pues hasta marzo 2021 reportó que el 5,4% corresponde a niños1. La declaración de la pandemia en Ecuador por enfermedad de coronavirus (Enfermedad por COVID-19), (virus SARS-CoV2) fue comunicada por el Ministerio de Salud Pública en marzo del 2020. A partir de esa fecha existió un aumento exponencial de la enfermedad. En febrero del 2021 la OMS informa la existencia de 111’102.016 casos confirmados con 2’462.911 fallecimientos en todo el mundo1. En Ecuador, hasta la actualidad se reportaron 457.489 casos confirmados con pruebas PCR y 21.545 personas fallecidas (confirmados COVID-19)2.
Los casos de niños contagiados a nivel mundial están reportados como menos frecuentes. En 2020, se notificaron más de 2’000.000 casos pediátricos de COVID-19 en los Estados Unidos. Hay estudios que revelan una mayor asociación de COVID-19 grave en niños más pequeños (de 2 a 11 años) en comparación con niños mayores (de 12 a 18 años)3. En España en la población pediátrica (desde el nacimiento hasta los 18 años) la incidencia de enfermedad clínica (COVID-19) es de 0,8-2,1% de la incidencia general a inicios de la pandemia. Actualmente según la Academia Americana de Pediatría el porcentaje puede llegar hasta el 14,8% de los casos4. La tasa de mortalidad por COVID-19 en población pediátrica a nivel mundial es menor del 0,08%. La tasa global de letalidad de la COVID-19 a nivel mundial es 2,22%. El Centro para Control y Prevención de Enfermedades (CDC) ha determinado que aproximadamente 2 a 3% de niños con COVID-19 positivos requerirían hospitalización siendo equivalente a 0,3 por cada 100.000 niños5. En Ecuador hasta marzo de 2021 la fuente oficial del MSP reportó 263.164 casos de los cuales el 5,4% corresponden a niños. Con una mortalidad general reportada en la edad pediátrica de 41 niños, lo que daría una letalidad calculada de 0,3%.
Se describen los casos de COVID-19 de pacientes pediátricos hospitalizados en un hospital privado de tercer nivel.
Objetivos
Describir la incidencia de casos de COVID-19, sus características demográficas, clínicas, la evolución, los biomarcadores de inflamación para severidad y el tratamiento de los niños hospitalizados por COVID-19 en un hospital de tercer nivel de la ciudad de Quito.
MATERIALES Y MÉTODOS
Se realizó un estudio transversal en 19 pacientes pediátricos entre 1 mes y 18 años de edad de ambos sexos, ingresados en el Hospital Metropolitano de Quito, desde marzo 2020 a abril 2021, con prueba positiva de reacción en cadena de la polimerasa por transcripción inversa en tiempo real (RT-PCR) en hisopado nasofaríngeo. Las variables a estudiar fueron: a) manifestaciones clínicas (fiebre, síntomas respiratorios, lesiones en piel, vómito, diarrea, hiporexia, dolor abdominal, síntomas neurológicos); b) marcadores de laboratorio (biometría hemática, procalcitonina, interleuquina-6, proteína C reactiva, dímero D y ferritina); c) estudios radiográficos; d) evolución clínica (tiempo de requerimiento de oxígeno); e) tratamiento (corticoide sistémico, broncodilatador inhalado, corticoide inhalado, antibioticoterapia); y, f) estancia media. Los datos fueron recopilados de la historia clínica única del sistema GEMA del Hospital Metropolitano de Quito.
Para el análisis descriptivo se utilizó, en variables cualitativas, porcentajes y, para cuantitativas, mediana y rango. Con la finalidad de establecer diferencias significativas se aplicó la prueba Chi cuadrado. Se consideró un resultado significativo una p<0,05. Se empleó el programa estadístico informático IBM SPSS statistics versión 25.
RESULTADOS
Características demográficas. El estudio demostró un mayor predominio de la enfermedad en pacientes de sexo femenino (14) 73,7%, (p 0,039) respecto al sexo masculino (5) 26,3%. De acuerdo al grupo etario, se describe la frecuencia con la que se presentó la enfermedad. (Tabla 1).
Tabla 1. Distribución por grupo etario en COVID-19.
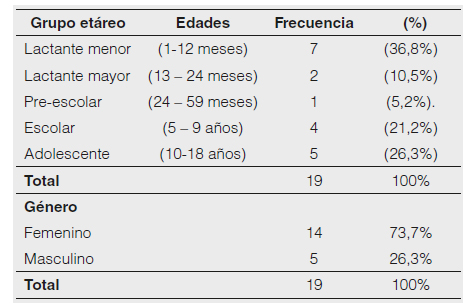
Fuente: Sistema GEMA del Hospital Metropolitano de Quito.
Características clínicas. Los síntomas asociados a infección por COVID-19 estadísticamente significativos fueron: síntomas respiratorios, lesiones en piel, hiporexia, diarrea, vómito, dolor abdominal, y síntomas neurológicos. Se describe por cada grupo etario el número de casos que presentan los síntomas y signos descritos en la tabla 2. También se describe el valor de p para cada síntoma y signo en toda la muestra.
Tabla 2. Características clínicas de COVID-19 en el Hospital Metropolitano.
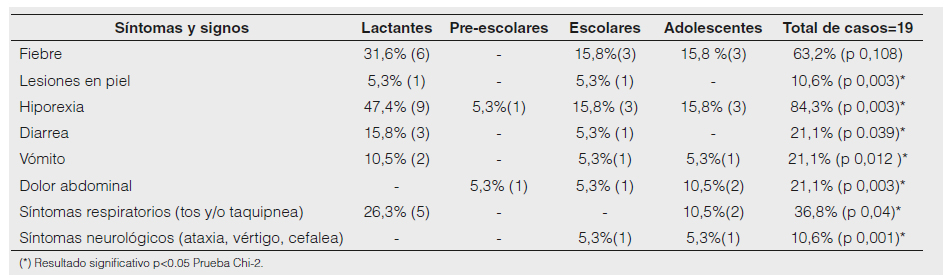
Fuente: Sistema GEMA del Hospital Metropolitano de Quito.
Diagnóstico y marcadores de laboratorio. El nexo epidemiológico fue en el 63,2% (p 0,251), sin significancia estadística. Respecto a la distribución de exámenes complementarios al estudio molecular con RT PCR SARSCOV-2 (hisopado nasofaríngeo), se efectuaron biometría hemática, PCR y biomarcadores de inflamación que indican gravedad (Tabla 3).
Tabla 3. Exámenes complementarios realizados a los pacientes ingresados en el Hospital Metropolitano de Quito.

Fuente: Sistema GEMA del Hospital Metropolitano de Quito.
Tabla 4. Niveles de biomarcadores de inflamación.
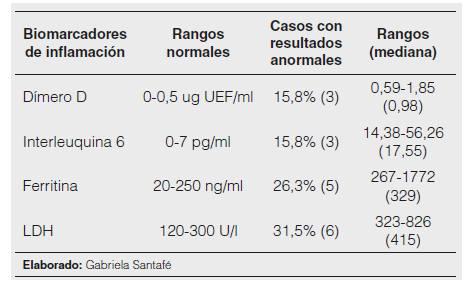
Referencia: Departamento de Hematología y Bioquímica del Hospital Metropolitano.
En los estudios de imagen, la radiografía de tórax fue realizada en el 89,5% (n=17) de los pacientes, en el abordaje inicial de la enfermedad. No se realizó radiografía de tórax en dos casos, el uno fue un rash inespecífico y el otro una neuritis vestibular. El hallazgo radiográfico patológico más frecuente fue el infiltrado de tipo alveolo-intersticial difuso bilateral en 26,3%. Se describen otros hallazgos con más detalle en la tabla 5.
Tabla 5. Hallazgos en radiografía de tórax.

Referencia: Departamento de Hematología y Bioquímica del Hospital Metropolitano.
Tratamiento y manejo clínico. La mediana de la estancia hospitalaria fue de 3 días con un rango entre 1 a 6 días. Ningún paciente falleció. De los casos reportados el 47,3% (n=9) necesitó apoyo de oxígeno a bajo flujo. En una media de requerimiento de oxígeno de 58 horas, con un mínimo de 24 horas hasta un máximo de 144 horas durante la hospitalización. Solo dos pacientes egresaron con apoyo de oxígeno y lo necesitaron por 7 días luego de su alta hospitalaria.
Respecto al manejo que tuvieron los pacientes, este se basó en medidas generales de soporte para el alivio de la sintomatología (analgesia e hidratación parenteral), como otros coadyuvantes: terapia respiratoria inhalada broncodilatador/corticoide, corticoide sistémico, antibioticoterapia, y en un solo caso anti-vertiginoso por sintomatología de neuritis vestibular y ninguno de los casos requirió cuidados intensivos.
Tabla 6. Terapia farmacológica.

Fuente: Sistema GEMA del Hospital Metropolitano de Quito
DISCUSIÓN
Este estudio demostró un mayor predominio de la enfermedad en pacientes de sexo femenino 73,7% (p 0,039). En estudios similares se ha encontrado que no hay una diferencia significativa en el sexo de los pacientes. Por ejemplo, la Agencia de Salud Pública de Ontario 2020, en su muestra de 34.035 casos en niños, el porcentaje fue levemente mayor en el sexo masculino (51,7%)6. De manera similar DeBiasi y colaboradores en un grupo de 35 pacientes hospitalizados no críticos, encontró una mayor incidencia, aunque leve, en el sexo femenino (56%)7. El presente estudio difiere de estas publicaciones ya que muestra mayor prevalencia en el sexo femenino.
En cuanto al grupo etario, nuestro estudio encontró que la incidencia fue mayor en niños menores de 12 meses, con un 42,1% de los casos reportados. Estos resultados difieren de lo reportado en una revisión del 2021 realizada en una biblioteca virtual, donde se indicó que en los Estados Unidos existió una mayor incidencia en adolescentes de 14-17 años8. Sin embargo, el grupo con mayor tasa de hospitalización fueron los menores de 1 año, que concuerda con la mayor incidencia de ingreso para ese grupo etario en nuestro estudio.
Las manifestaciones clínicas en niños son muy variables de acuerdo con reportes sobre COVID-19. Los siguientes son los síntomas que se presentaron en pacientes con cuadros leves o moderados: fiebre, fatiga, dolor de cabeza, mialgia, tos, congestión nasal o rinorrea, pérdida del gusto u olfato, dolor de garganta, disnea o dificultad para respirar, dolor abdominal, diarrea, náuseas o vómitos y falta de apetito o mala alimentación9. En un metaanálisis que incluyó 9.335 niños de 0 a 19 años de países como China y Estados Unidos, los síntomas que se presentaron con mayor frecuencia fueron fiebre 63%, tos 34%, nausea/vómito 20%, diarrea 20%, disnea 18%, síntomas nasales 17%, lesiones de piel 16%, fatiga 16%, dolor abdominal 15%, síntomas neurológicos 12% y conjuntivitis 11%8,10.
El estudio coincidió con otros estudios con muestras más grandes, que incluyeron poblaciones de otros continentes, tanto la fiebre y los síntomas respiratorios fueron los que se presentaron con mayor frecuencia11. Pero debemos mencionar que la fiebre, a pesar de ser un síntoma frecuente en niños con COVID-19, según ciertos estudios de series de casos realizado en China, se presenta hasta en el 100% de casos, en nuestra muestra no fue estadísticamente significativo, esto debido a que en la edad pediátrica la fiebre es un motivo de consulta muy común, representa entre el 20-30% de visitas médicas y no es un síntoma característico al momento del diagnóstico diferencial12,13. Los síntomas más frecuentes en nuestro estudio fueron hiporexia 84,3%, fiebre 63,2% y los síntomas respiratorios 36,8% del grupo evaluado.
Pocos estudios han reportado sobre la hiporexia o alteraciones del apetito. Dos estudios señalaron una frecuencia entre 18-23%12 en relación a estos síntomas. En nuestro estudio se presentó en el 84,3% de los pacientes y fue un porcentaje superior al de la fiebre 63,2%. Debemos tener en cuenta que SARS-CoV-2 ingresa a las células a través del receptor de la enzima convertidora de angiotensina-2 (ECA-2), el cual se expresa abundantemente en las células pulmonares, pero también en los enterocitos. Hay varios mecanismos etiopatogenéticos para explicar los síntomas gastrointestinales que van desde la pérdida de la absorción intestinal, la inflamación microscópica de la mucosa y la función alterada de la ECA-2, todo esto tiene un papel importante en el mantenimiento de la homeostasis intestinal14. Además, la diarrea es otro síntoma gastrointestinal que en ciertos estudios se ha reportado con una frecuencia del 8% al 13%, siendo en nuestro estudio del 21,1%15.
En el metaanálisis, Irfan y colaboradores recopilaron 129 estudios de los cuales 66 incluyeron niños (de 0 a 19 años) con SARS-CoV-2 documentado, los cuales proporcionaron detalles sobre alteraciones en marcadores de laboratorio. El análisis combinado reveló en el hemograma (leucopenia, linfopenia), aumento de la proteína C reactiva (PCR), ferritina sérica, lactato deshidrogenasa (LDH) y Dímero D como las alteraciones más frecuentes9. Además, la Federación Internacional de Química Clínica y Medicina de Laboratorio recomendó realizarlas en pacientes sintomáticos1. En nuestra muestra se realizó estos biomarcadores de laboratorio al 57,9%11 de los niños, se encontró elevado el dímero D y la IL-6 en el 15,8%3 respectivamente, la ferritina en el 26,3%5 y la LDH en el 31,5%6 de los casos. El hemograma se realizó a todos los pacientes admitidos en la hospitalización y estuvo alterada con leucopenia en el 21%4, linfopenia el 26,3%5 y neutropenia en el 21%4. De igual manera, en el estudio de Shahin y colaboradores se realizó el hemograma a todos sus 88 pacientes pediátricos, para documentar el comportamiento de esta nueva enfermedad y los cambios en el hemograma, siendo una de las pruebas diagnósticas más utilizadas en la práctica médica habitual y que permite determinar con fiabilidad, rapidez y un bajo coste las alteraciones en los parámetros hematológicos en sangre periférica, y asi contribuir al diagnóstico en niños con COVID-1916,17.
En cuanto a los estudios de imagen los Centros para el Control y la Prevención de Enfermedades actualmente no recomiendan rutinariamente realizar radiografía o tomografía computarizada de tórax (TC) para diagnosticar COVID-1918. Un estudio retrospectivo realizado en 59 pacientes pediátricos en abril 2020 en Turquía, concluyó que no se indica el uso de estudios de imagen en los casos pediátricos si no hay un hallazgo clínico que lo justifique. La radiografía de tórax es el primer método de imagen preferido en pacientes pediátricos que clínicamente se considera que tienen neumonía por COVID-19. La TC de tórax se puede realizar en pacientes con hallazgos radiológicos patológicos. Se afirmó que los hallazgos de imágenes de TC de tórax son similares a las encontradas en adultos. Sin embargo, los hallazgos en la radiografía de tórax, típicamente preferida en pacientes pediátricos, para protegerlos de la radiación, no se han informado ampliamente debido a la baja incidencia de neumonía por COVID-19 en pacientes pediátricos19. En nuestro estudio se realizó radiografía de tórax al 89,5% de los casos, y se encontró alteraciones radiográficas en el 47,3% de los pacientes; los hallazgos fueron infiltrado de tipo intersticial peribroncovascular bilateral, difuso bilateral, en vidrio esmerilado y reticular y atrapamiento aéreo.
El tratamiento de los pacientes pediátricos, de acuerdo a las actualizaciones hasta abril del 2021 en la guías del National Institute of Health (NHI) indican que debido a datos limitados sobre la patogenia y el espectro clínico de la enfermedad por COVID-19 en niños, la falta de datos pediátricos de ensayos clínicos aleatorios controlados con placebo y limitados a datos de estudios observacionales, no hay al momento recomendaciones establecidas para el tratamiento de COVID-1920.
La mayoría de los niños con enfermedad presentan un cuadro leve a moderado y pueden tratarse únicamente con cuidados de soporte que incluye hidratación, apoyo con oxígeno en caso de hipoxemia y antitérmicos1. El uso de antibióticos se considerará ante una sobreinfección.
Remdesivir, Tocilizumab, anticuerpos monoclonales, no tienen una evidencia fuerte en pacientes pediátricos y han sido utilizados en pacientes con presentación clínica severa20. En nuestro estudio, tomando en cuenta las recomendaciones actuales para el tratamiento, se utilizaron corticoides sistémicos asociado a broncodilatador inhalado. El resto de pacientes de acuerdo a su cuadro clínico: síntomas respiratorios con hiperreactividad bronquial recibió broncodilatadores y corticoides inhalados (36,8%), azitromicina (5,3%) y en dos casos cefalosporinas de tercera generación y aminoglucósido (10,5%). En nuestro estudio se reportó una mediana de 3 días de estancia hospitalaria, sin requerimiento de cuidados intensivos , similar a un reporte del CDC sobre mortalidad y morbilidad, en un grupo de 208 niños con una mediana de estancia hospitalaria de 2,5 días (rango 1 a 5 días)21,22.
CONCLUSIÓN
El estudio demostró que existió una descripción similar a la epidemiología mundial por COVID-19 en niños en cuanto a sintomatología y evolución. Siendo un grupo etario con predominio de lactantes menores y sexo femenino.
La prueba utilizada fue PCR-RT por hisopado nasofaríngeo para el diagnóstico.
El cuadro clínico más frecuente fueron signos y síntomas respiratorios de leves a moderados, acompañados de fiebre y requerimiento de oxígeno. A pesar de la fiebre ser un síntoma frecuente en los pacientes infectados, no fue estadísticamente significativo a diferencia de la hiporexia y los síntomas respiratorios que sí lo fueron en nuestro grupo de estudio.
Los hallazgos radiográficos fueron: infiltrado alveolo intersticial difuso bilateral en el 26,3% de los casos, incremento del intersticio peribroncovascular bilateral en un 10,5%, el atrapamiento aéreo e infiltrado de tipo vidrio esmerilado paracardíaco /reticular en el 5,2% de los casos respectivamente.
En los estudios biométricos no se observaron alteraciones importantes excepto en el 21%4 que presento leucopenia y 26,3%5 con linfopenia.
De los 19 pacientes 11 requirieron biomarcadores inflamatorios de los cuales se encontró elevado el dimero D, ferritina, IL-6 y LDH. Se consideran por lo tanto marcadores de severidad en pacientes que requieren hospitalización y que presentan clínica de moderada a severa.
La mediana hospitalaria fue de tres días.
La serie de pacientes evolucionaron favorablemente sin requerimiento de terapia intensiva y con mortalidad nula.
Dos pacientes requirieron alta hospitalaria con apoyo mínimo de oxígeno por 11 días en total.
La muestra de nuestro estudio (19 casos ) en un año es estadísticamente pequeña se requiere una recopilación de una muestra más amplia y un seguimiento permanente de los pacientes.
Contribución de los autores
GS: Concepción y diseño del trabajo; recolección y obtención de resultados; análisis e interpretación de datos; redacción del manuscrito.AJ: Concepción y diseño del trabajo; análisis e interpretación de datos. Revisión final.
Conflictos de Intereses
Los autores declaran no tener conflictos de intereses.
Manejo de datos y declaración de confidencialidad
Los autores en el contexto de un estudio retrospectivo declaramos respetar la privacidad del individuo y mantener la confidencialidad de la información que se derive de la participación en el estudio.
Financiamiento
Los autores realizaron el financiamiento de los gastos incurridos en la producción de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
Santafé Troncoso G, Cáceres Aucatoma F, Morán Arias S, Acebo Arcentales J. COVID-19 Características clínicas, radiológicas y de laboratorio en niños ingresados en un Hospital de tercer nivel. Metro Ciencia [Internet]. 30 de septiembre de 2021; 29(3):11-17. https://doi.org/10.47464/MetroCiencia/vol29/3/2021/11-17