

Validación endoscópica de la cromoendoscopía virtual (FICE)
en la detección de lesiones preneoplásicas gástricas vs. histopatología
Endoscopic validation of virtual chromoendoscopy (FICE) in the
detection of gastric preneoplastic lesions vs. histopathology
Recibido: 16-08-2021
Aceptado: 23-02-2022
Publicado: 31-03-2022
Revista MetroCiencia
Volumen 30, Número 1, 2022
Editorial Hospital Metropolitano
Mercedes Isabel Guamán Guamán1
Introducción: Las lesiones preneoplásicas gástricas están asociados con un mayor riesgo de progresión a cáncer gástrico. La endoscopia digestiva alta convencional y la histopatología son el patrón de oro para el diagnóstico de estas lesiones. Sin embargo, la cromoendoscopía virtual (FICE: Fuji Intelligent Chromo Endoscopy), y; la magnificación endoscópica (ME) permiten una mejor caracterización de estas lesiones. El objetivo es evaluar la concordancia visual endoscópica convencional y la cromoendoscopía virtual (FICE) con ME utilizando el sistema de clasificación de Kimura-Takemoto y el sistema histopatológico SIDNEY modificado en sujetos que acuden a la consulta externa de Gastroenterología del Hospital Eugenio Espejo. Metodología: Estudio epidemiológico analítico, transversal de período, en el que se incluyeron 140 participantes. Resultados: Se encontró presencia de lesiones preneoplásicas gástricas en el 67% detectadas por FICE con ME; mientras, que por histopatología se detectaron 54% de lesiones. El diagnóstico endoscópico por FICE tuvo una sensibilidad de 97,53% especificidad de 67,79% VPP de 80,61% y VPN de 95,23%. En una submuestra 90 sujetos con lesiones preneoplásicas consideradas de menor riesgo se observó una sensibilidad de 98,55%, especificidad de 5%, VPP de 78,16% y VPN de 50%. Para displasia se observó una sensibilidad de 80%, especificidad del 100%, VPP de 100% y VPN de 97,56%. En el análisis de la relación del género masculino con presencia de lesiones preneoplásicas se observó una sensibilidad de 92,30%, Especificidad de 46,15%, VPP de 63,15% y VPN de 85,71%. Se detectaron 4 casos de cáncer gástrico por cromoendoscopía con sensibilidad y especificidad del 100% que fueron confirmados por histopatología. Finalmente, el 60% de los sujetos presentan infección por Helicobacter Pylori, de los cuales la mayoría corresponden a sujetos con metaplasia intestinal y atrofia multifocal. Conclusión: La detección de las lesiones preneoplásicas gástricas mediante el uso de cromoendoscopía virtual tipo FICE y ME tiene una alta sensibilidad, por lo tanto, se recomienda como screening para la detección de lesiones preneoplásicas gástricas en el Ecuador.
Palabra Claves: gastritis crónica atrófica, metaplasia intestinal, displasia, cáncer gástrico, endoscopia convencional, cromoendoscopía virtual, magnificación endoscópica, sistema SIDNEY, sistema Kimura-Takemoto.
Introduction: Gastric preneoplastic lesions are associated with an increased risk of progression to gastric cancer. Conventional upper gastrointestinal endoscopy and histopathology are the gold standard for the diagnosis of these lesions. However, virtual chromoendoscopy (FICE: Fuji Intelligent Chromo Endoscopy), and; Endoscopic Magnification (EM) allow a better characterization of these lesions. The objective is to evaluate the conventional endoscopic visual concordance and virtual chromoendoscopy (FICE) with EM using the Kimura-Takemoto classification system and the MODIFIED SIDNEY histopathological system in subjects attending the Gastroenterology outpatient clinic of Hospital Eugenio Espejo. Methodology: Analytical epidemiological study, cross-sectional period, in which 140 participants were included. Results: Presence of gastric preneoplastic lesions was found in 67% detected by FICE with EM; while, by histopathology, 54% of lesions were detected. The endoscopic diagnosis by FICE had a sensitivity of 97.53%, specificity of 67.79% PPV of 80.61% and NPV of 95.23%. In a subsample of 90 subjects with preneoplastic lesions considered to be of lower risk, a sensitivity of 98.55%, specificity of 5%, PPV of 78.16% and NPV of 50% were observed. For dysplasia, a sensitivity of 80%, specificity of 100%, PPV of 100% and NPV of 97.56% were observed. In the analysis of the relationship between the male gender and the presence of preneoplastic lesions, a sensitivity of 92.30%, specificity of 46.15%, PPV of 63.15% and NPV of 85.71% were observed. Four cases of gastric cancer were detected by chromoendoscopy with 100% sensitivity and specificity that were confirmed by histopathology. Finally, 60% of the subjects present Helicobacter Pylori infection, of which the majority correspond to subjects with intestinal metaplasia and multifocal atrophy. Conclusion: The detection of preneoplastic gastric lesions using virtual chromoendoscopy type FICE and ME has a high sensitivity, therefore, it is recommended as a screening for the detection of preneoplastic gastric lesions in Ecuador.
Keywords: chronic atrophic gastritis, intestinal metaplasia, dysplasia, gastric cancer, conventional endoscopy, virtual chromoendoscopy, endoscopic magnification, SIDNEY system, Kimura-Takemoto system.
Mercedes Isabel Guamán Guamán
![]() https://orcid.org/0000-0001-7405-8895
https://orcid.org/0000-0001-7405-8895
 |
Este artículo está bajo una licencia de Creative Commons de tipo Reconocimiento – No comercial – Sin obras derivadas 4.0 International. |
*Correspondencia:ismerint@gmail.com
La gastritis atrófica (GA), metaplasia intestinal (MI), y la displasia del estómago llamadas también lesiones preneoplásicas gástricas, están asociados con un mayor riesgo de cáncer gástrico (CG), y según la Organización Mundial de la Salud (OMS) son consideradas patologías que tiene un gran impacto en la morbimortalidad mundial1,2.
Las lesiones preneoplásicas y el cáncer gástrico temprano (CGT) son frecuentemente encontradas en estómagos con gastritis crónica atrófica y/o metaplasia intestinal3, mientras que en estudios de Latinoamérica aún se reporta que un 90% de casos de CG son diagnosticados en estadios avanzados lo cual empobrece el pronóstico4. Según Calle y colaboradores en un estudio hecho en Cuenca, Ecuador, reportaron que la prevalencia de metaplasia es de 37,23%5. En un estudio realizado en el Perú, se estudiaron 2616 pacientes, de los cuales 187 (7,1%) presentaron diagnostico histológico de lesiones gástricas preneoplásicas: 34 (1,3%) gastritis atrófica (GA), 55 (2,1%) metaplasia intestinal completa (MIC), 92 (3.5%) metaplasia intestinal incompleta (MII), y 6 (0,2%) displasia6. Las prevalencias reportadas pueden variar ampliamente dentro de las poblaciones, probablemente debido a una variedad de factores metodológicos como problemas de selección de las poblaciones de estudio7.
La naturaleza del problema radica en que no existe un estándar de oro para diagnóstico histopatológico ni endoscópico de lesiones preneoplásicas tempranas, así lo demuestran varios estudios desde una correlación pobre hasta aceptable entre los hallazgos endoscópicos e histológicos en pacientes con GC5,6, aun usando el último consenso endoscópico e histológico, mostrado en Sydney7-10. Entre las variables para establecer el grado de GA y MI, los métodos más utilizados son la evaluación endoscópica e histológica de las muestras de biopsia gástrica11. En los países asiáticos como Japón, considerados de alta prevalencia de CG, la presencia y extensión de las lesiones preneoplásicas a menudo se establecen mediante endoscopia12, usando la clasificación basada en la progresión del borde de atrofia gástrica denominada Bordes Atróficos Endoscópicos (EAB), reportada por Kimura y Takemoto, la cual se basa en la transición entre gastritis atrófica y gastritis no atrófica, llegando a considerarse como el mejor índice de correlación endoscópica-histológica para atrofia gástrica13, la cual describe a los cambios que existen en el límite entre el territorio de la mucosa antral y fúndica, identificada por el cambio de color y altura de las glándulas14. El área de atrofia se distingue por ser más amarillenta y se evidencian los vasos submucosos15. El grado de atrofia se ha identificado de la siguiente manera; se divide en dos tipos: tipo C que corresponde a lesiones ubicadas únicamente en la curvatura menor, y tipo O que abarcan más allá de la curvatura menor extendiéndose en paredes anterior y posterior del estómago13. Sin embargo, este método requiere una experiencia considerable por parte de los endoscopistas9.
Para el muestreo de biopsias se recomienda evaluar de acuerdo con el sistema de Sydney que describe las lesiones encontradas a nivel de estómago y permite identificar objetivamente las lesiones en la mucosa según aspectos histológicos y endoscópicos. La clasificación endoscópica se la describe topográficamente dependiendo del lugar de la lesión, antro, cuerpo o todo el estómago, y los hallazgos que se utilizan para la misma son: edema, eritema, friabilidad, erosión plana, erosión rugosa, nodularidad, hiperplasia rugosa, atrofia rugosa, visión de los vasos y hemorragia, más el grado de intensidad de la misma11.
Por otro lado, la interpretación histológica abarca cinco características: inflamación, actividad, atrofia, metaplasia intestinal, presencia de HP; al igual valora la cronicidad de la gastropatía y la localización topográfica de la lesión9.
La endoscopia digestiva alta (EDA) es el estudio que permite la visualización directa de la mucosa gástrica y es útil para obtener las biopsias que nos darán el diagnóstico histopatológico de lesiones preneoplásicas, además de CG16,17. Debido a la pobre concordancia entre la EDA y la histopatología, la biopsia gástrica sigue siendo el patrón de oro para diagnosticar gastritis crónica (GC), AG, MI y displasia las cuales son consideradas lesiones preneoplásicas del CG5,7,8.
Varios estudios muestran que con la endoscopia convencional no se puede diagnosticar de forma fiable gastritis por HP, AG, y MI18-20. Sin embargo, en los últimos años el diagnóstico de las lesiones premalignas gástricas ha experimentado un gran cambio propiciado por el desarrollo de nuevos endoscopios provistos con tecnologías como la cromoendoscopía virtual con el uso del FICE (Fuji Intelligent Chromo Endoscopy), que permiten resaltar la apariencia de las variaciones en la mucosa gástrica, principalmente las formas del patrón de las criptas glandulares en el estómago, asociado a la observación del patrón vascular superficial, dando la detección de lesiones que no pudieron ser observadas con endoscopia convencional de luz blanca, permitiendo dirigir la biopsia y aumentar la sensibilidad diagnóstica de cambios histológicos, lesiones preneoplásicas gástricas y también cáncer gástrico temprano (CGT), el uso además de magnificación endoscópica (ME) aumenta la capacidad de diagnóstico de las lesiones15,20-22.
De esta manera, la evidencia actual sugiere que la cromoendoscopía de magnificación (MCE) mejora la precisión para la detección de lesiones preneoplásicas gástricas, así sugieren Dinis-Ribeiro y colaboradores y proponen una clasificación para el diagnóstico de estas lesiones que la consideran altamente reproducible y exacta23. Por lo tanto, el sistema FICE es útil en la determinación de AG con y sin metaplasia, con buenos resultados24-26.
Debido a que el CG en el Ecuador es el segundo más común en hombres y el tercero en mujeres; y, en el análisis por provincias se encuentran grandes diferencias en la mortalidad27-29. Radica su importancia en que las lesiones preneoplásicas gástricas son comunes y están asociadas con un mayor riesgo de CG. En ausencia de directrices, existe una amplia disparidad en el tratamiento de pacientes con estas condiciones premalignas. La Sociedad Europea de Endoscopia Gastrointestinal (ESGE) en el año 2011 reunió a 63 expertos de 24 países y emité recomendaciones para el manejo de las lesiones preneoplásicas y lesiones gástricas; y se centraron en el tratamiento y la vigilancia9.
La infección por HP desempeña un papel fundamental en esta progresión señalada por Pelayo Correa, y se ha clasificado como un carcinógeno de tipo 1 en 1994 por la Organización Mundial de la Salud (OMS). Inclusive hay estudios que sugieren que la erradicación de HP, podría revertir la MI e inclusive detener su progresión a CG30-32. Por otro lado, la edad, más de 50 años, también se ha relacionado con mayor incidencia de MI, así lo demuestran el trabajo realizado por Sehmus et al. y otras publicaciones previas donde afirman que a mayor edad mayor incidencia de MI33,34. Esto se corrobora en un trabajo realizado localmente donde se concluye que la MI es más frecuente en pacientes entre los 30 y 80 años de edad, existiendo una mayor prevalencia entre los pacientes de 40-49 años35.
Las publicaciones hasta aquí citadas evidencian que la suma de factores como HP, y las lesiones preneoplásicas gástricas son factores de riesgo que predisponen a desarrollar CG33, lo que conlleva nuestra mayor atención brindando métodos de diagnóstico y seguimiento oportuno y apropiado, en este caso con el sistema FICE para garantizar la salud integral de esta población en riesgo9.
Basados en estas premisas, se evalúa la concordancia entre el sistema de clasificación endoscópica de Kimura-Takemoto y el sistema de clasificación anatomo-patológica SYDNEY, además de estudiar la utilidad de la cromoendoscopía con el sistema FICE en el diagnóstico de atrofia gástrica, metaplasia intestinal, displasia. Esto permite identificar a los sujetos con riesgo elevado de transformación maligna, con el fin de determinar el proceso de seguimiento más conveniente para un paciente de acuerdo con los hallazgos, sumado a esto el hecho de que nuestro país se encuentra dentro de la banda de países con elevada incidencia de CG2.
En este contexto, el objetivo de este estudio es determinar que el sistema FICE como método de screening para la detección de lesiones premalignas gástricas es sensible, comparado con la histopatología en sujetos que acuden a la Consulta Externa del Hospital Eugenio Espejo.
Para la demostración de la hipótesis se aplicó un estudio epidemiológico analítico, transversal de período. La información que se requiere para realizar esta investigación se obtuvo del departamento de Video Endoscopia del Hospital de Especialidades Eugenio Espejo de Quito, entidad que forma parte de los escenarios del posgrado de Gastroenterología y Endoscopia Digestiva.
El universo está conformado por los pacientes que acuden a la consulta externa de Gastroenterología del Hospital Eugenio Espejo que cumplan con los criterios de inclusión y exclusión. Los criterios de inclusión fueron pacientes comprendidos entre las edades de 20 y 75 años y pacientes sometidos a endoscopia digestiva alta; y los criterios de exclusión fueron paciente con diagnóstico endoscópico de adenocarcinoma gástrico y aquellos que se negaron a participar en el estudio.
Se aplicó el muestreo aleatorio para el universo homogéneo, infinito de variable cualitativa, mediante la siguiente expresión:
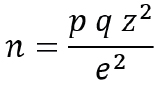
Donde z es el nivel de confianza 95% (1,96), p es la variabilidad positiva (37,3%), q es la variabilidad negativa o probabilidad de no ocurrencia calculada como q=1-p (62,7%) y e es la precisión o error de inferencia (8%). Para la selección de la muestra se aplicó la asignación secuencial, cumpliendo los criterios de inclusión y exclusión.
Se elaboró una base de datos en el programa estadístico Excel. Se utilizó estadígrafos para determinar la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo y la prevalencia. Los resultados serán ordenados, procesados y analizados mediante tablas y viabilidad.
La muestra está formada por 140 pacientes y fue obtenida del universo de pacientes que acudieron al servicio de Video Endoscopia del Hospital Eugenio Espejo para la realización de una endoscopia digestiva alta por presentar sintomatología digestiva. El 74% corresponde a mujeres y el 26% a hombres. El promedio de edad fue de 50,77 ± 15,24 años, y rango entre 20 y 75 años.
De los 140 registros obtenidos, 94 pacientes (67%) presentan lesiones preneoplásicas gástricas detectadas por EDA con FICE, de las cuales la mayoría corresponden a atrofia focal en 31 pacientes (22%). Sin embargo, 27 pacientes (19%) presentan lesiones mixtas, es decir, atrofia multifocal con metaplasia intestinal multifocal, seguidas por la atrofia multifocal en 21 pacientes (15%) consideradas de mayor relevancia por su gravedad y extensión. La DG se encontró en 6 pacientes (4%) siendo reportada por el patólogo como displasia de alto grado. Existen 4 pacientes (3%) con lesión endoscópica compatible con cáncer gástrico (Tabla 1).
Tabla 1. Distribución porcentual de las lesiones preneoplásicas gástricas diagnosticadas por FICE en pacientes que acuden a video endoscopía del Hospital Eugenio Espejo.
| Variable | N° | % |
| Atrofia focal | 31 | 22% |
| Atrofia multifocal |
21 | 15% |
| Metaplasia intestinal | 9 | 6% |
| Displasia | 6 | 4% |
| Lesiones mixtas | 27 | 19% |
| Cáncer | 4 | 3% |
| Normal | 42 | 30% |
| TOTAL | 140 | 100% |
Fuente: Base de datos de la autora.
Del total de 140 sujetos estudiados, 75 (54%) pacientes presentan diagnóstico histopatológico de lesiones preneoplásicas gástricas; siendo más frecuente la presencia de lesiones mixtas en 28 pacientes (20%) y la mayoría de ellos fueron de localización multifocal. Según la histología se confirmaron 19 casos de atrofia focal (14%), seguido por la atrofia multifocal en 13 pacientes (9%), 10 casos de metaplasia intestinal (7%), 5 pacientes (4%) con displasia de alto grado, 6 pacientes (4%) con cáncer gástrico. Finalmente, en 59 pacientes (42%) no se reportó ningún tipo de lesión preneoplásica gástrica por parte del patólogo (Tabla 2).
Tabla 2. Distribución porcentual de las lesiones preneoplásicas gástricas diagnosticadas por histopatología en pacientes que acuden a video endoscopía del Hospital Eugenio Espejo.
| Variable | N° | % |
| Atrofia focal | 19 | 14% |
| Atrofia multifocal |
13 | 9% |
| Metaplasia intestinal | 10 | 7% |
| Displasia | 5 | 4% |
| Lesiones mixtas | 28 | 20% |
| Cáncer | 6 | 4% |
| Normal | 59 | 42% |
| TOTAL | 140 | 100% |
Fuente: Base de datos de la autora.
La sensibilidad de la cromoendoscopía virtual tipo FICE frente al diagnóstico proporcionado por la histopatología mostró una adecuada precisión diagnóstica para lesiones preneoplásicas gástricas con una sensibilidad del 97,53% y especificidad del 67,79%. Por lo tanto, es una herramienta útil con una elevada capacidad de detectar lesiones preneoplásicas gástricas en sujetos que se realizan una endoscopia digestiva alta. Además, el VPP elevado de esta prueba nos indica un 80,61% de probabilidad de que los sujetos en quienes se detecte una alteración de la mucosa tengan realmente una lesión preneoplásica gástrica y un 95,23% de probabilidad de no encontrar lesiones gástricas en sujetos que realmente no son portadores de estas lesiones (Tabla 3).
Tabla 3. Relación entre el diagnóstico endoscópico por FICE e histopatología de las lesiones preneoplásicas gástricas en pacientes que acuden a video endoscopía del Hospital Eugenio Espejo.
| HISPATOLOGÍA | ||||
| FICE | SI | NO | ||
| N° | % | N° | % | |
| SI (98) | 79 | 80,61 % | 19 | 19,38% |
| NO (42) | 2 | 4,76 % | 40 | 95,23% |
| Sensibilidad: 97,53%, Especificidad: 67,79%, VPP: 80,61%, VPN: 95,23% | ||||
Fuente: Base de datos de la autora.
Se analizó una submuestra de 90 pacientes que presentaron lesiones preneoplásicas gástricas como atrofia gástrica y metaplasia intestinal multifocal mediante el uso de cromoendoscopía virtual FICE, con una elevada sensibilidad de 98,55%, para detectar a los sujetos que realmente tienen las lesiones. Sin embargo, la especificad es apenas del 5%; es decir, muy baja probabilidad de que los sujetos que se someten a FICE en realidad no tienen estas lesiones, la baja especificidad indica la necesidad de biopsias dirigidas. El VPP de 78% nos indica que en los sujetos en quienes se observe una lesión preneoplásica gástrica tengan una alta probabilidad de ser portadores realmente de estas lesiones, lo que contrasta con el VPN de únicamente el 50% de probabilidad de que los sujetos identificados como no portadores de las lesiones gástricas realmente no la tengan (Tabla 4).
Tabla 4. Relación entre diagnóstico endoscópico por FICE e histopatología de lesiones preneoplásicas gástricas de menor riesgo en pacientes que acuden a video endoscopía del Hospital Eugenio Espejo.
| HISPATOLOGÍA | ||||
| FICE | SI | NO | ||
| N° | % | N° | % | |
| SI (88) | 68 | 78,40 % | 19 | 21,59% |
| NO (2) | 1 | 50 % | 1 | 50% |
| Sensibilidad: 98,55%, Especificidad: 5%, VPP: 78,16%, VPN: 50% | ||||
Fuente: Base de datos de la autora.
La validación de la cromoendoscopía virtual tipo FICE frente al gold estándar que es la histopatología mostró una muy buena sensibilidad del 80% para la detección de displasia y especificidad del 100%, lo cual le convierte en una tecnología altamente recomendable por elevada capacidad de detección de esta lesión considerada de alto riesgo de progresión a cáncer gástrico en sujetos con lesiones de menor de riesgo, además su elevado VPP del 100% permite identificar displasia con un buen nivel de confiabilidad en sujetos realmente enfermos, como también descarta esta posibilidad en quienes no la padecen con un VPN del 97,56% (Tabla 5).
Tabla 5. Relación entre diagnóstico endoscópico por FICE e histopatología en displasia en pacientes que acuden a video endoscopía del Hospital Eugenio Espejo.
| HISPATOLOGÍA | ||||
| FICE | SI | NO | ||
| N° | % | N° | % | |
| SI (4) | 4 | 100% | 0 | 0% |
| NO (41) | 1 | 2,43% | 40 | 97,56% |
| Sensibilidad: 80%, Especificidad: 100%, VPP: 100%, VPN: 97,56% | ||||
Fuente: Base de datos de la Autora.
Los resultados de la prueba diagnóstica para la detección de lesiones preneoplásicas gástricas en relación con el género mostraron un valor de sensibilidad del 92,30%, lo que la convierte en un método alternativo útil con un alto nivel de confiabilidad para el diagnóstico precoz de esta patología en el género masculino que son identificados como el grupo de mayor riesgo de desarrollo de cáncer gástrico. Aunque su especificidad es baja, de apenas un 46,5% de probabilidad de que utilizando este método no se detecten lesiones de la mucosa gástrica en un sujeto verdaderamente sano. El análisis nos indica que en un 63,15% de los pacientes con valores positivos detectados por nuestra prueba, finalmente se confirmó la presencia de lesiones preneoplásicas gástricas; mientras, que el grupo en el que fue negativa la cromoendoscopía virtual tipo FICE un 85,71% estaban efectivamente sanos (Tabla 6).
Adicionalmente, la detección endoscópica con FICE de lesiones de la mucosa compatibles con cáncer gástrico, en este caso en estadio precoz, es tan útil como la histopatología con valores de sensibilidad y especificidad del 100%. En el análisis también se observa que del total de los 140 pacientes, 66 (47%) presentan infección por Helicobacter Pylori, de los cuales la mayoría corresponden al grupo con lesiones preneoplásicas mixtas.
Tabla 6. Relación entre diagnóstico endoscópico por FICE e histopatología de lesiones preneoplásicas de menor riesgo con el género.
| HISPATOLOGÍA | ||||
| FICE | SI | NO | ||
| N° | % | N° | % | |
| SI (19) | 12 | 63,15% | 7 | 36,84% |
| NO (7) | 1 | 14,28% | 6 | 85,71% |
| Sensibilidad: 92,30%, Especificidad: 46,15%, VPP: 63,15%, VPN: 85,71% | ||||
Fuente: Base de datos de la autora.
El correcto diagnóstico de lesiones preneoplásicas gástricas tiene importancia clínica por estar asociados con un mayor riesgo de progresión a CG, y según la OMS son consideradas patologías que tiene un gran impacto en la morbimortalidad mundial1,2. La identificación correcta de estas lesiones y un seguimiento adecuado permiten identificar casos de cáncer gástrico temprano; sin embargo, estudios de Latinoamérica aún reportan que un 90% de casos de CG son diagnosticados en estadios avanzados lo cual empobrece el pronóstico4. En nuestro estudio se reportó una prevalencia global de lesiones preneoplásicas gástricas del 64% que incluyen desde atrofia focal, multifocal, metaplasia intestinal multifocal y displasia.
Un estudio previo realizado por Calle y colaboradores en Cuenca estableció que la prevalencia de metaplasia intestinal es de 37,23%5. En otro estudio realizado en el Perú, se estudiaron 2616 pacientes, de los cuales 187 (7,1%) presentaron diagnóstico histológico de lesiones gástricas preneoplásicas: 34 (1,3%) gastritis atrófica (GA), 55 (2,1%) metaplasia intestinal completa (MIC), 92 (3,5%) metaplasia intestinal incompleta (MII), y 6 (0,2%) displasia6. Se conoce que las prevalencias reportadas pueden varían ampliamente dentro de las poblaciones, probablemente debido a una variedad de factores metodológicos como problemas de selección de las poblaciones de estudio7.
La edad promedio de pacientes atendidos fue de 50,77 ± 15,24 años, con un rango de edad de 20 a 75 años, datos similares a varios estudios. Y el sexo femenino representó el 74%, debido a que más mujeres se someten a endoscopias digestivas, similares resultados que en otros estudios publicados46,48. La validación del FICE frente al diagnóstico proporcionado por la histopatología mostró una muy buena sensibilidad del 97,53% y especificidad del 67,79% y VVP y VPN de 80,61% y 95,23%, respectivamente. Por lo tanto, se constituye en una herramienta útil en detectar las lesiones preneoplásicas gástricas en la población de riesgo señalada. Esto se corrobora con la evidencia actual que sugiere que la cromoendoscopía digital con magnificación mejora la precisión para la detección de estas lesiones, así lo publican Dinis-Ribeiro y colaboradores y proponen una clasificación para el diagnóstico de estas lesiones que la consideran altamente reproducible y exacta23-26.
Para graduar la GA y MI nos basamos en el protocolo de SIDNEY combinando información topográfica y morfológica según el sistema endoscópico de Kimura-Takemoto. Aunque pocos estudios han sido publicados respecto a esta correlación endoscópica vs. histopatología; en algunos de ellos se ha demostrado desde una pobre hasta aceptable relación entre estas variables para detección de lesiones preneoplásicas5,6. En los países asiáticos como Japón, considerados de alta prevalencia de CG, la presencia y extensión de las lesiones preneoplásicas a menudo utilizando estas variables ha llegado a considerarse como el mejor índice de correlación endoscópica-histológica para atrofia gástrica13. Sin embargo, este método requiere una experiencia considerable por parte de los endoscopistas9.
En el análisis de una submuestra de 90 pacientes que presentaron lesiones preneoplásicas gástricas de menor riesgo como atrofia gástrica tanto focal como multifocal y metaplasia intestinal multifocal mediante el uso de FICE, se encontró una elevada sensibilidad de 98,55%. Sin embargo, la especificidad es apenas del 5%; es decir, muy baja probabilidad de que los sujetos que se someten a FICE en realidad no tienen estas lesiones, en nuestro estudio la baja especificidad indica la necesidad de realizar biopsias dirigidas por cromoendoscopía ya que a mayor número de biopsias mayor posibilidad de confirmar la presencia de lesiones por histopatología5. Esto se explicaría en nuestro caso debido a una probable sobreestimación de atrofia focal con FICE mientras que con histopatología únicamente se detectó AG en el 14%. Estos hallazgos son similares a los de Bejarano, quien describe que, con respecto a la atrofia y metaplasia, el uso de FICE ha dado mayor contraste respecto a la mucosa normal, con una excelente precisión diagnóstica. En el estudio endoscópico se apreció una mejoría notable del contraste de las áreas de metaplasia, respecto a áreas sin metaplasia, por lo que el autor considera que sí existe sobreestimación de la atrofia con la cromoendoscopía virtual, esto respecto principalmente a los estadios leves de atrofia a sin metaplasia36.
La validación de la cromoendoscopía virtual tipo FICE frente al gold estándar mostro una muy buena sensibilidad del 80% para la detección de displasia en este caso de bajo grado y especificidad del 100%, lo cual le convierte en una tecnología altamente recomendable por la elevada capacidad de detección de esta lesión considerada de alto riesgo de progresión a cáncer gástrico en sujetos con lesiones de menor riesgo, además su elevado VPP del 100% permite identificar displasia con un buen nivel de confiabilidad en sujetos realmente enfermos, como también descarta esta posibilidad en quienes no la padecen con un VPN del 97,56%. Sin embargo, en algunos trabajos se demuestra que la displasia de bajo grado rara vez progresa a displasia de alto grado y que hasta en 50% de los casos esta lesión regresa espontáneamente37. Según la literatura se sabe que el tiempo transcurrido entre el diagnóstico de displasia de alto grado y el carcinoma es entre algunas semanas y 39 meses. Por tanto, el diagnóstico confirmado de displasia de alto grado es, para la mayoría de los autores, una indicación clara de resección quirúrgica. No obstante, gracias al avance de las técnicas de localización y estadificación, como la cromoendoscopía y la ecoendoscopía, se pueden seleccionar casos susceptibles de resección endoscópica38-40. En nuestro caso no se detectaron casos de displasia de alto grado.
Los resultados de la prueba diagnóstica para la detección de lesiones preneoplásicas gástricas en relación con el género mostraron un valor de sensibilidad del 92,30%, lo que la convierte en un método alternativo útil con un alto nivel de confiabilidad para el diagnóstico precoz de esta patología en el género masculino que son identificados como el grupo de mayor riesgo de desarrollo de cáncer gástrico, que en nuestro estudio también se lo relaciona como factor de riesgo asociado a lesiones preneoplásicas gástricas. Sin embargo, en estudios publicados las relaciones entre estas lesiones y el género han sido raramente observadas y en otros casos no se ha detectado la asociación6. Adicionalmente, mediante la tecnología FICE, aplicada en estómagos que además presentaron metaplasia intestinal multifocal con atrofia multifocal, se encontraron 3 casos de lesiones gástricas compatibles con cáncer gástrico con valores de sensibilidad y especificidad del 100%, lo que lo convierte en una herramienta muy útil que permite dirigir la biopsia para incrementar la sensibilidad diagnóstica en estos casos como se corrobora en la literatura con buenos resultados26. En el análisis de nuestro estudio también se observa que la prevalencia de infección por Helicobacter pylori fue de 47%, de los cuales la mayoría corresponden al grupo con lesiones preneoplásicas mixtas, es decir, AG y MI multifocal.
La cromoendoscopía virtual tipo FICE tiene alta sensibilidad en la detección de lesiones preneoplásicas gástricas, permite imágenes más claras sin el uso de tintes, dirige mejor las biopsias, y caracteriza mejor las lesiones, siempre y cuando se lo realice por profesionales con entrenamiento. La cromoendoscopía virtual FICE con magnificación endoscópica aumenta la capacidad de predecir el tipo histológico de las lesiones preneoplásicas gástricas a valores que pueden influir en la toma de decisiones con los pacientes al momento del procedimiento endoscópico sin tener que esperar el reporte histopatológico definitivo. La técnica de magnificación con FICE demostró una sensibilidad elevada en la detección de displasia en lesiones preneoplásicas. Por último, esta técnica nos ha mostrado elevada sensibilidad para diagnóstico de infección por H. pylori de hasta 95%.
Recomendaciones
El diagnóstico de lesiones preneoplásicas gástricas de manera oportuna se puede realizar con endoscopia de luz blanca. Sin embargo, su caracterización mejora con cromoendoscopía virtual y magnificación endoscópica por lo que se remienda su uso para disminuir la morbimortalidad del cáncer gástrico.
Contribución de los autores
Isabel Guamán: Concepción y diseño del trabajo; recolección y obtención de resultados; análisis e interpretación de datos; redacción del manuscrito.
Conflicto de interés
Los autores declararon no tener ningún conflicto de interés personal, financiero, intelectual, económico y de interés corporativo con el Hospital Metropolitano y los miembros de la revista MetroCiencia.
Financiación
Financiación propia.
CITAR ESTE ARTÍCULO:
Guamán Guamán MI. Validación endoscópica de la cromoendoscopia virtual (FICE) en la detección de lesiones preneoplásicas gástricas vs. histopatología. Metro Ciencia [Internet]. 30 de marzo de 2022; 30(1):61-70. https://doi.org/10.47464/MetroCiencia/vol30/1/2022/61-70
MetroCiencia VOL. 30 Nº 1 (2022)