

Editorial: Hospital Metropolitano
ISSN (impreso) 1390-2989 - ISSN (electrónico)2737-6303
Edición: Vol. 29 (suppl 1) 2021 - agosto
DOI: https://doi.org/10.47464/MetroCiencia/vol29/supple1/2021/49-63
URL: https://revistametrociencia.com.ec/index.php/revista/article/view/224
Pág: 49-63
Finalidad
Trataremos en este capítulo todo lo que debe hacerse una vez obtenida la recuperación de la circulación espontánea (RCE) después de un paro cardiaco (PC). Esto lo haremos de acuerdo a la evidencia disponible en la literatura y las recomendaciones que de ella salgan. Pero es muy importante adaptar esas recomendaciones a la realidad de nuestro continente latinoamericano, por lo que trataremos de dar nuestra recomendación de práctica diaria adaptada como sugerencia de los autores. El paciente que recupera el pulso con las medidas de resucitación cardiopulmonar (RCP) puede presentar una falla multiorgánica. Preferimos referirnos a esta etapa de la reanimación como síndrome post paro (SPP), y no post reanimación, ya que esta etapa es parte de la reanimación. De hecho, desde las guías de RCP del 2010, es parte de la cadena de sobrevida y constituye el 5° eslabón de la cadena1 (fig. 1).
El manejo del SPP en adultos ha mostrado buenos resultados en sobrevida y resultados neurológicos, incorporando la angioplastia de emergencia y el manejo de la temperatura post recuperación de la RCE. Ya sabemos que el PC pediátrico tiene peor pronóstico que el de adultos por su origen asfíctico. Como ya veremos en los casos post paro de pediatría, lo que hagamos en esta etapa es muy importante, pero el pronóstico final dependerá de la causa del paro y del tiempo que el niño haya estado sin oxígeno y sin perfusión de los órganos. Un porcentaje importante de niños que son inicialmente reanimados fallecen luego de la RCE, en los días o semanas siguientes, y esto puede ocurrir por fracaso hemodinámico, muerte cerebral o adecuación del esfuerzo terapéutico.
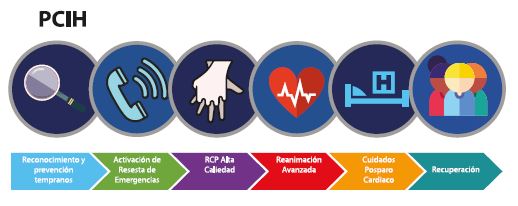
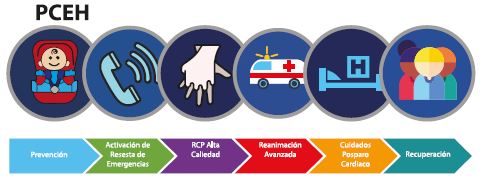
Figura 1. Adaptación de los eslabones de sobrevida. 5° eslabón: de los cuidados post paro.
Adaptado de las guías RCP 2020. PCIH=paro cardiaco intrahospitalario. PCEH=paro cardiaco extrahospitalario.
Objetivos
General:
Definir el SPP, establecer las medidas terapéuticas y conocer los factores pronósticos de la RCP en la función neurológica y buena calidad de vida a largo plazo.
Específicos:
Escenario
Cualquiera que sea el escenario donde ocurrió un PC y donde se realizó la RCP (pre hospitalario, urgencia, salas de hospital o la UCIP), al recuperar la circulación espontánea se inicia de inmediato el manejo del SPP en el lugar de la RCP, hasta que el paciente sea trasladado a una UCIP. La mayoría de las veces el manejo no será iniciado por un médico especialista en cuidados intensivos pediátricos.
Definiciones y conceptos básicos
Síndrome post paro: Definido en el año 2008 en un amplio consenso internacional, cambió profundamente la importancia de los cuidados post paro, con implicancias de concepto (incorporación del último eslabón a la cadena de la sobrevida) y de manejo con un paquete de medidas que resumen los cuidados post paro2,3. Definen el síndrome post paro 4 situaciones:
Se describen 4 fases en el SPP y en ellas tenemos prioridades de tratamiento con un enfoque multisistémico en cada fase. Se puede evaluar el pronóstico y debe iniciarse precozmente la rehabilitación del paciente (fig. 2)4.

Figura 2. Etapas del SPP. Adaptado de Topjian. Pediatric Post-Cardiac Arrest Care. Circulation 2019; 140: e194-e233 (4). ROSC=recuperación de la circulación espontánea.
Causas de muerte post paro:
Fisiopatología del síndrome post paro:
Lesión cerebral anóxica: disrupción de la homeostasis del calcio, formación de radicales libres, muerte celular por alteración de las vías de la señal celular, lesión por reperfusión, ausencia de reinicio de los flujos normales. Lesiones adicionales secundarias (prevenibles con un buen manejo del SPP): fiebre, hiperglicemia, hiperoxigenación (ver más adelante).
Disfunción miocárdica relacionada al paro: fenómeno de aturdimiento, hipocinesia global, elevación de la presión al final de la diástole del ventrículo izquierdo, flujo coronario preservado.
Respuesta sistémica de isquemia/reperfusión: hipoperfusión global intraparo, lesión por reperfusión con activación endotelial, inflamación sistémica, activación de las cascadas de coagulación, extravasación capilar con hipovolemia secundaria, alteración de la vasoregulación, riesgo de infección.
Patología precipitante persistente: causa del PCR no resuelta como insuficiencia respiratoria, sepsis, hipovolemia, arritmias, metabólicas, otras.
Lo que ocurre luego de la RCE es una respuesta sistémica a la reperfusión, con una cascada inflamatoria y de la coagulación muy similar al síndrome de respuesta inflamatoria sistémica (SIRS) causado por sepsis, con hipovolemia, vasodilatación, hipoperfusión, daño endotelial y alteración de la microcirculación. Esta respuesta inflamatoria es proporcional al tiempo de anoxia, de paro, y a la situación pre-PC. La respuesta secundaria a la noxa inicial es poco modificable. Pero la respuesta secundaria al daño por reperfusión, es muy influenciable por lo que hagamos en el manejo del SPP. Hay estudios que muestran mejoría en la sobrevida hasta 4 veces en centros con protocolos de manejo de SPP. El paciente debe ser manejado en forma similar al paciente con sepsis, con un manejo guiado por metas.
Recomendaciones
El manejo del SPP incluye un paquete (bundle, por su nombre en inglés) de medidas que ha demostrado mejores resultados en términos de sobrevida y mejores resultados neurológicos.
Paquete (Bundle) de medidas del SPP:
Las guías RCP recientemente publicadas en octubre 20205 incorporan una lista de comprobación (check list) de la atención post paro y que resume todas las acciones a realizar en esta etapa de la RCP (Figura 3).
A y B. Manejo de la vía aérea y respiración: estabilización respiratoria
Si el paciente logra la RCE sin coma y con buen esfuerzo respiratorio, podría no intubarse. Se debe mantener una saturación de oxihemoglobina de > 94%. La hipoxemia y la hipercapnia pueden aumentar el riesgo de un nuevo PC y de agregar una noxa cerebral secundaria. Si el paciente que logra la RCE presenta alguna disfunción neurológica debe mantenerse intubado y conectado a ventilación mecánica (VM).
Oxigenación post PC
Estudios en animales sugieren que pO2 tisulares elevadas después de la RCE contribuyen al estrés oxidativo que puede potenciar el SPP y, estudios en adultos, muestran asociación entre hiperoxemia y aumento de la mortalidad6,7. En pediatría 3 estudios pequeños no mostraron asociación, pero un estudio observacional más grande de 1427 casos de PC pediátrico extrahospitalario (PCEH) e intrahospitalario (PCIH), mostró que la normoxemia (PaO2 ≥ 60 y < 300 mmHg) se asoció con aumento de la sobrevida al alta de la UCIP8.
Ventilación (PaCO2) post PC
La autorregulación cerebral vascular después de la RCE puede estar anormal. Datos de adultos muestran peor resultado en pacientes con hipocapnia post RCE8,9. En otros tipos de lesión cerebral pediátrica, hipocapnia se asocia a peores resultados clínicos10. En post paro pediátrico los estudios son escasos, uno no mostró relación entre hipocapnia y peor pronóstico, y otro sí13-15.
Evaluación, monitorización y exámenes
El paciente debe mantener una monitorización continua del trazado ECG, saturación de la oxihemoglobina y medición del CO2 espirado (capnografía), presión arterial invasiva y temperatura central. Los gases arteriales permiten evaluar el estado ácido-base y establecer una correlación con saturación y capnografía, lo que permitirá un monitoreo no invasivo continuo.
Ecografía y radiografía de tórax: evaluar posición del tubo traqueal, catéter venoso central, imágenes pulmonares. Se debe realizar una evaluación clínica frecuente de la presencia de cianosis, expansión torácica y auscultación pulmonar para descartar complicaciones:
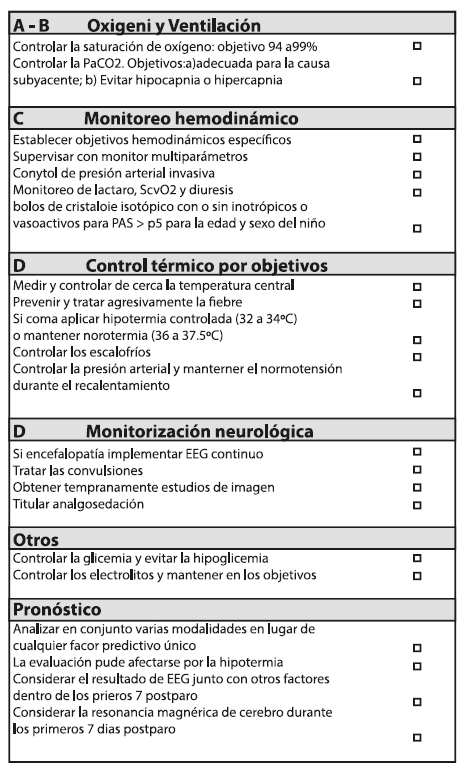
Metas y objetivos según grado de evidencia:
Normoxemia con SpO2 94-98%, PaO2 70-90 mmHg, y normocapnia con PaCO2 35-45 mmHg. Evitar la hipoxia e hiperoxia que agrava estrés oxidativo y el daño neurológico post reperfusión (recomendación débil, evidencia de muy baja calidad. Clase Ilb, LOE B-NR)9-14. Fuera de la UCIP, donde la monitorización puede ser menos estricta, es mejor asegurar que no haya episodios de hipoxia que es claramente más dañina que la hiperoxia. Es razonable poner una meta de PaCO2 post RCE que sea apropiada a la condición específica del paciente y que evite hipercapnia e hipocapnia severas (Clase Ilb, LOE C-LD). Protección pulmonar con ventilación gentil y evitando asincronías, pero sin permitir la hipercapnia permisiva que muchas veces es consecuencia de una ventilación protectora.
Tratamiento:
Recomendación LATAM de práctica diaria:
Nuestra recomendación de oxigenación y ventilación es mantener una saturación transcutánea de la oxihemoglobina entre 94 y 98%, en lo posible usar capnografía y mantener una PaCO2 35-45 mmHg luego de la RCE. Mientras el paciente se encuentre en VM usar los parámetros de ventilación protectora que recomiendan las guías internacionales y el comité de respiratorio de SLACIP: FIO2 < 0.6, presión de meseta < 30 y presión sobre PEEP menor a 16.
Circulación: estabilización hemodinámica
El primer objetivo de la reanimación es conseguir la RCE. La siguiente tarea es mantenerla hasta lograr una estabilización, lo que va a ocurrir, en el mejor de los casos, en las próximas horas o días. El retomar la circulación espontánea no asegura un buen pronóstico final. Dependiendo de la causa, el tiempo y las medidas realizadas en la reanimación, el estado hemodinámico generalmente estará, en mayor o menor medida, comprometido, y formará parte de un Síndrome de Fallo Multiorgánico (FMO). Como consecuencia, además de una disfunción miocárdica variable, están presentes fenómenos de isquemia-reperfusión, por lo que se impone un seguimiento sistemático seriado.
Para la reanimación la adrenalina sigue siendo la mejor opción. Pero una vez retomado una circulación espontánea eficaz va a requerir continuar con apoyo farmacológico, donde la elección del inotrópico se debería ajustar a la situación particular, en base a objetivos y metas. La obtención de una sobrevida al alta va a depender en gran medida de los cuidados brindados.
Fisiopatología
El deterioro de la función cardíaca que sigue al PC asocia 3 fenómenos: a) Isquemia, que sigue a la ausencia o al bajo flujo; b) Injuria por reperfusión; y, c) Injuria secundaria a las catecolaminas o shock por descargas aplicadas, ambas medidas utilizadas en la reanimación. La isquemia inicial es responsable de la disfunción cardíaca (“corazón aturdido”) y el síndrome isquemia-reperfusión que causa una liberación de citoquinas, activación de proteínas inmunológicas y de factores de la coagulación responsable de la disregulación vasogénica que explicaría la vasoplejia, hipotensión, disfunción endotelial con fuga capilar todo lo que conduce a una hipovolemia. Estos 3 elementos llevan a una hipoperfusión tisular que, si se mantiene en el tiempo, condiciona una FOM por respuesta inflamatoria sistémica similar a la sepsis37,52. La disfunción cardiaca es global (biventricular, sistólica y diastólica), está presente independientemente de la causa, y su persistencia se asocia a la mortalidad precoz. Es sensible a los fármacos inotrópicos.
Secundariamente a la restauración del flujo, se produce un aumento transitorio de las catecolaminas circulantes que explican un estado hiperdinámico inicial, con variaciones del ritmo cardíaco y de la presión arterial. Las resistencias vasculares sistémicas y pulmonares están aumentadas en la fase precoz inmediata, pero rápidamente se instala una disfunción miocárdica, sisto-diastólica, siendo máxima a las 24 horas, resolviéndose en la mayoría de los casos en 72 horas. La disfunción está marcada por una hipocinesia global del miocardio, asociado a un bajo débito cardiaco. Las complicaciones hemodinámicas frecuentemente encontradas son disfunción cardíaca, hipotensión y arritmias ventriculares, particularmente en las primeras 6 horas que siguen a la RCE.
Evaluación y monitorización
Desde el punto de vista clínico, hay que realizar una evaluación continua de las variables hemodinámicas empezando por la bomba cardíaca o la evaluación cardiovascular central, de frecuencia y ritmo cardiaco, así como determinar la presencia de silencios o ritmo de galope. También se debe evaluar elementos de sobrecarga derecha (edemas) o izquierda (estertores crepitantes bilaterales a nivel de ambos campos pulmonares). La presencia de edema pulmonar no es infrecuente. La presencia de taquicardia mantenida se asocia con mal pronóstico34.
A nivel de macrohemodinamia, comprobar pulsos centrales y periféricos, presión arterial. Posteriormente, en algunas situaciones hay que realizar la monitorización de presión invasiva. En series de pacientes adultos, los mejores resultados neurológicos finales se observaron en quienes se logró obtener presiones arteriales dentro de valores normales. En estudios observacionales en la edad pediátrica se observó un peor pronóstico asociado a hipotensión post RCP, definida hipotensión como una presión sistólica inferior al percentil 5 correspondiente a la edad. De contar con la posibilidad, se podrá evaluar la presión venosa central; más importante que el valor inicial, es evaluar su variabilidad en respuesta al tratamiento instituido. A nivel microhemodinamia se evalúa la perfusión periférica, frialdad, cianosis, tiempo de recoloración o llenado capilar.
La monitorización básica en la cama del paciente es con un monitor cardíaco multiparamétrico con frecuencia cardíaca, saturómetro de oxígeno y presión arterial no invasiva seriada. Si se cuenta con capnógrafo, es de utilidad. Si se cuenta, con un monitor de presiones invasivas sería ideal porque permite un más estrecho control, titulación y evaluación de la respuesta terapéutica y así como evaluar los cambios realizados. La utilidad de la presión venosa central para estimar la precarga es algo discutido en los últimos años y además requiere la colocación de un acceso central.
No es suficiente asegurar una macro y microhemodinamia, hay que completar con datos que muestren la situación tisular. La misma la evaluaremos en forma seriada con gasometrías y curva de lactato. En un tiempo posterior es conveniente monitorizar y titular drogas con presiones invasivas.
La dosificación de troponina luego de las 48 horas, es el mejor indicador de la disfunción miocárdica y tiene una buena correlación con la tasa de supervivencia en la infancia. Si se cuenta en la unidad, la incorporación y entrenamiento de una ecocardiografía funcional, realizada por los propios médicos, permite repetirlo las veces que se entienda necesario, lo que permitiría ajustes terapéuticos más rápidos, de no contar el mismo se debe hacer con ecocardiograma doppler repetido, sobretodo en pacientes inestables. El mismo nos informa de zonas de hipoquinesia, así como el grado de disfunción global37.
Estudios en pediatría son limitados, pero se encuentra asociación entre la disminución de la fracción de acortamiento y la elevación de la troponina con mortalidad en una serie pequeña de casos. En otra serie pequeña luego de 24 horas del ingreso el 41% presentó disminución de la función sistólica izquierda y también se asoció con incremento en la mortalidad. Las arritmias observadas son las contracción auriculares y ventriculares prematuras, taquicardias supraventriculares y taquicardias ventriculares que se detectan al monitor y se evalúan con electrocardiograma.
Metas u objetivos
Las intervenciones de soporte deben ser intensas, precoces con el objetivo de estabilizar y limitar la progresión de las injurias. No existe un único protocolo terapéutico establecido tanto en adultos como en pediatría. El tratamiento debería ser guiado por metas, e incluye asegurar una adecuada volemia, soporte inotrópico y vasoactivos.
En todos los casos hay que tener presente otras comorbilidades previas presentes. En adultos la presencia de hipotensión en las primeras 6 horas post RCP se asocia con una mortalidad elevada, por tanto, el manejo hemodinámico agresivo mejora el pronóstico
Objetivos:
Metas:
Tratamiento
No hay una pauta única en la elección de los fármacos, ni dosis, por tanto, el tratamiento se debe ajustar en cada caso particular, titulando la respuesta y guiado por los objetivos para alcanzar las metas. La inestabilidad hemodinámica se manifiesta por bajo gasto cardíaco, hipotensión y arritmias.
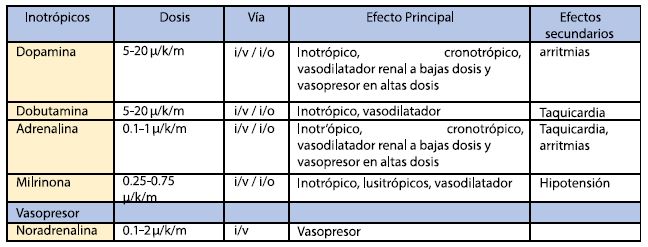
La primera intervención es asegurar una adecuada volemia, sin elementos de sobrecarga izquierda ni derecha. Para asegurar la misma se puede realizar una carga de 20 mL/kg de cristaloides como solución salina isotónica, en 2 alícuotas a fin de ir evaluando la respuesta. En segundo lugar, y si no hay una marcada hipotensión, la incorporación de un inotrópico que apoye la disfunción cardiaca en forma precoz sería apropiado. Los vasopresores están indicados cuando se constate hipotensión que no mejoró con volumen con el objetivo de optimizar la perfusión coronaria y ayuda a mantener la perfusión cerebral. En dosis elevadas pueden causar vasoconstricción e incremento del consumo de oxígeno (tabla 1).
El tratamiento antiarrítmico profiláctico no está indicado. El tratamiento se debe ajustar a la causa; las despolarizaciones prematuras usualmente no requieren antiarrítmicos específicos, se corrige con una adecuada perfusión, volemia y electrolitos séricos. En el caso de arritmias ventriculares, se plantea la lidocaína, previamente hay que considerar si presenta alteraciones cardiovasculares premórbidas. Las drogas que prolongan el intervalo QT o inotrópicos negativos en general están contraindicadas (amiodarona, procainamida, sotalol)37. La aplicación de ECMO como terapia de rescate en aquellos casos en que no se logra estabilizar y/o presentan riesgo elevado de reiterar el PC, se asoció con reducción de mortalidad. Los riesgos asociados incluyen lesiones vasculares, compromiso de laperfusión distal, hemorragia pulmonar, infecciones y sangrados. No es una técnica accesible en todos lados34.
Recomendaciones LATAM de práctica diaria
Recomendamos implementar una monitorización hemodinámica invasiva con los objetivos de alcanzar euvolemia, normotensión, gasto cardiaco adecuado y transporte de oxígeno óptimo a los tejidos. Debe vigilarse la perfusión distal, la diuresis, la presencia de arritmias, la corrección de la acidosis y el aclaramiento de lactato.
La hemoglobina podría mantenerse cercana a 10 g/dL para optimizar el contenido arterial de oxígeno.
D Discapacidad neurológica: lesión cerebral post-paro cardiaco
Después de un PC, la lesión cerebral secundaria, o encefalopatía hipóxico – isquémica (EHI), explica gran parte de la morbimortalidad de estos pacientes. En el PC extrahospitalario (PCEH), la sobrevida al alta alcanza 38%1 y el desenlace neurológico favorable hasta un 77%2. En el PC intrahospitalario (PCIH) la sobrevida alcanza 43.4%3; si el PCIH se produce en la UCIP, la sobrevida alcanza 45% y el 89% de los sobrevivientes obtienen un desenlace neurológico favorable4.
Fisiopatología
A diferencia de lo que ocurre con adultos, el PC en niños es fundamentalmente producido por asfixia (80 – 90%), en la cual un periodo de hipoxemia, bradicardia e hipotensión precede al PC. También se debe considerar los mecanismos específicos de la condición que causó el PC, como asfixia, arritmia, hemorragia, trauma o sepsis, así como factores del paciente (etapa de desarrollo cerebral) o factores intra-PC como son la oportunidad y la calidad de la RCP, o el tiempo hasta la RCE6.
La lesión cerebral post-PC se explica por la especial susceptibilidad del cerebro a diversos factores como hipoxia, hiperoxia, isquemia, hipotensión, hiperemia, edema e hipertermia.
Estos fenómenos son comunes en las 3 primeras fases del SPC que transcurren desde el inicio de la circulación espontanea hasta aproximadamente 72 horas post-PC. El resultado final es necrosis y apoptosis neuronales, las cuales pueden producirse incluso días a semanas después7,8. También se han descrito poblaciones neuronales más vulnerables al daño hipóxico – isquémico con células no tienen una distribución vascular única, ni representan zonas de hipoperfusión o zonas marginales entre territorios vasculares (watershed)9. La muerte de estas neuronas ocurre en forma retardada después de la reperfusión y, en consecuencia, existe el potencial de minimizar el daño, al menos en parte, con intervenciones terapéuticas.
En resumen, los mecanismos que explican el daño cerebral causado por el PC son:
Estudios experimentales han encontrado cambios en el FSC después del PC. Hay una fase temprana de hiperperfusión (especialmente a nivel subcortical) y una fase subsecuente tardía de hipoperfusión (especialmente a nivel cortical); el grado de afectación del FSC varía en relación a la duración del PC. El FSC regional suele ser heterogéneo, en especial durante la fase de hipoperfusión5. En pacientes con buena evolución neurológica, el FSC se recupera después de 24 – 72 horas y la reactividad al CO2 se mantiene intacta. En pacientes que no recuperan la consciencia o que progresan a muerte encefálica, persiste la hiperemia y se pierde la reactividad al CO2, que parece ser un signo universal de mal pronóstico6,10.
Evaluación y manifestaciones clínicas
Pueden observarse afectación del estado de consciencia hasta el coma, encefalopatía, convulsiones, cambios pupilares (anisocoria, midriasis, alteración de la respuesta fotomotora), afectación de pares craneales, mioclonías, diversos grados de disfunción neurocognoscitiva, edema cerebral, hipertensión intracraneana, estado vegetativo persistente y muerte encefálica. Las convulsiones aparecen en 30 – 50% de los niños que han sufrido un PCR, pueden ser clínicas o pueden ser evidenciadas solamente con el monitoreo electroencefalográfico (EEG); suelen aparecer inmediatamente antes o durante el calentamiento en los pacientes que han recibido hipotermia terapéutica5. En los niños que mantienen un cierto grado de alteración de consciencia puede observarse en ocasiones una disfunción autonómica con respuesta excesiva a los estímulos sensoriales que se presenta como un estado de hiperalerta simpática con labilidad emocional, agitación, alucinaciones, pánico, trastornos del sueño, ansiedad, o daño autoinfligido8.
Estudios de imagen
La tomografía computada (TC) de cerebro permite descartar causas cerebrales del PC (trauma, hemorragia, masa, hidrocefalia) e investigar sus consecuencias, entre ellas edema cerebral (mala diferenciación entre sustancia gris y blanca) o hipodensidad consistente con infarto. Un estudio de adultos mostró que la presencia de edema en una TC realizada dentro de las primeras 2 horas post-PC puede ser indicativa de hipotermia controlada13. La resonancia magnética (RM) de cerebro puede mostrar múltiples imágenes hiperintensas en corteza y ganglios basales en T2 y en difusión; la espectroscopía, en las mismas regiones, puede mostrar disminución de Nacetilaspartato y aumento de lactato6.
Monitorización
Recomendaciones basadas en la evidencia:
Las recomendaciones que se presentan en esta sección provienen, en su mayor parte, de las actualizaciones 2019 de American Heart Association (CPR & ECC Guidelines)14,15. El manejo respiratorio y circulatorio se trata en otras secciones; sin embargo, la normoxemia y la normocapnia, así como la optimización hemodinámica son indispensables para la recuperación neurológica.
Sedoanalgesia, es razonable considerarla en los niños que se encuentran en ventilación mecánica, así como en los pacientes con hipotermia controlada con el propósito de suprimir los escalofríos (recomendación AHA clase IIb, nivel de evidencia C)14. No existen datos sobre el tipo de medicamento o combinación de medicamentos más apropiados en niños después de un PC7, aunque la guía PALS 2010 de la AHA menciona morfina, fentanyl, midazolam o lorazepam como opciones16. La selección de medicamentos deberá considerar la posibilidad de inducción de alteraciones hemodinámicas que condicionen hipoperfusión cerebral. Los opiáceos en bolo o en infusión son considerados los medicamentos de primera línea para el manejo de los escalofríos8; como alternativas se cita al paracetamol y al sulfato de magnesio17. Si se generan riesgos derivados de agitación o los escalofríos no pueden controlarse, puede adicionarse un relajante muscular por intervalos cortos; en estos casos conviene un monitoreo EEG continuo.
EEG y control de convulsiones: se debe realizar el EEG e interpretarlo rápidamente después del PC para el diagnóstico de convulsiones; idealmente se debe repetir con frecuencia o mantenerlo en forma continua (recomendación AHA clase I, nivel de evidencia C-LD)14. Se recomienda iniciar el monitoreo EEG lo más pronto posible, continuarlo por 24 – 48 horas en la mayoría de los pacientes, aunque, en los niños tratados con hipotermia, prolongarlo hasta 24 horas después de alcanzada la normotermia18. El tratamiento de las convulsiones incluye los mismos medicamentos que se usan para tratar las convulsiones de otras causas (recomendación AHA nivel IIb, nivel de evidencia C-LD)14. Como medicamentos de primera línea se citan a las benzodiazepinas, levetiracetam, fenitoína, valproato de sodio, barbitúricos o propofol; los eventos adversos a considerar son depresión respiratoria, hipotensión, arritmias o interferencias con la evaluación neurológica8,19. En niños que permanecen con encefalopatía después de un PC, 10 a 50% pueden presentar convulsiones, en muchos casos subclínicas; mientras más alterado se muestra el EEG de base, más riesgo de convulsiones8.
PIC: No existen estudios prospectivos sobre la monitorización de la PIC después de un PC. Una elevación sostenida de la PIC > 20 mmHg puede predecir un desenlace malo en niños con asfixia por inmersión. Sin embargo, el umbral de PIC para mal pronóstico suele estar por debajo del umbral de hipertensión intracraneana y, por ello, muchos pacientes tienen mal pronóstico a pesar de tener valores normales de PIC. La habilidad de controlar la hipertensión intracraneana no se asocia con mejor pronóstico. La monitorización rutinaria de la PIC y el tratamiento dirigido al control de la misma no están actualmente recomendados después del PC6.
Líquidos y electrolitos: se usan para alcanzar los objetivos de hidratación adecuada, normovolemia y normotensión. No se conoce el fluido ideal6 o el nivel ideal de sodio plasmático en el síndrome post-PC, aunque, por lógica, la hiponatremia debe evitarse. De igual forma, las soluciones hipotónicas deben evitarse20 teniendo en cuenta que en todas las patologías neuroquirúrgicas están recomendadas las soluciones isotónicas (por ejemplo solución salina 0.9%) y el mantenimiento de niveles normales de natremia. Tampoco se conoce el uso de terapia osmolar en esta patología; al inicio puede justificarse su uso frente a casos de hipertensión intracraneana, pero debe evitarse la deshidratación que puede inducir el manitol.
Hemoglobina: un estudio de la oxigenación cerebral mediante NIRS en adultos mostró que niveles bajos de hemoglobina se asocia con mala oxigenación cerebral y peor pronóstico21. Se encontró que niveles menores a 10 g/dL se asociaron a oxigenación cerebral más baja. Al contrario, hubo una asociación significativa con un buen resultado neurológico cuando la hemoglobina al ingreso estuvo sobre 13 g/dL (OR 2.76, 95% CI 1.09:7.00, p=0.03) o la hemoglobina promedio se mantuvo sobre 12.3 g/dL (OR 2.88, 95%CI 1.02:8.16, p=0.04)21.
Glicemia: el objetivo es mantener valores normales de glucosa en sangre. En general, sobre todo inmediatamente después del PC, se recomienda en lactantes y niños, evitar las soluciones dextrosadas. En adultos, es incierto el rango objetivo dentro del cual debe manejarse la glicemia (recomendación AHA clase IIb, nivel de evidencia B-R)14; en niños la situación parece ser similar6. Debe evitarse la hiperglicemia (por su asociación con peor desenlace en niños con asfixia por inmersión y trauma craneal), la hipoglicemia, así como las fluctuaciones bruscas e intensas del nivel de glucosa. No existe evidencia suficiente en la literatura para recomendar un método de monitorización de la glicemia o de regulación de la misma8. Mantener valores de hasta 8 mmol/L (145 mg/dL) podría ser razonable22; un estudio de hipotermia controlada en niños usó un nivel de 80 – 180 mg/dL23.
Control térmico por objetivos, normotermia controlada o activa, e hipotermia controlada: los mecanismos potenciales de neuroprotección inducidos por la hipotermia son (6): reducción del metabolismo oxidativo, mantenimiento de los niveles de glucosa y ATP en el cerebro, disminución de la producción cerebral de lactato cerebral, oposición a la excitoxicidad, oposición al flujo intracelular de calcio, control del estrés oxidativo, y efecto antiinflamatorio.
Los objetivos terapéuticos en el control térmico son mantener la normotermia, evitar o tratar agresivamente la hipertermia (por su asociación con peor evolución) o, en algunos casos, usar hipotermia controlada. El texto de reanimación avanzada pediátrica de European Resuscitation Council 2015 aconseja un control estricto de la temperatura para evitar tanto la hipertermia (>37.5°C) como la hipotermia severa (<32°C)24. AHA recomienda un control térmico por objetivos en adultos que permanecen comatosos (falta de respuesta a los comandos verbales) después de la recuperación de la circulación espontánea (recomendación AHA clase I, nivel de evidencia B-R para PCEH causado por un ritmo no desfibrilable, y para PCIH)14. También está recomendado seleccionar y mantener una temperatura constante entre 32 - 36°C (recomendación AHA clase I, nivel de evidencia B-R)14. No hay contraindicación para esta estrategia, pero características particulares de cada paciente permiten facilitar la selección de una temperatura determinada. Por ejemplo, la temperatura seleccionada será mayor si cifras más cercanas a 32°C implican más riesgo (p.e. sangrado). Por el contrario, si el comportamiento clínico implica riesgos con temperaturas altas (p.e. convulsiones, edema cerebral), entonces se seleccionarán temperaturas más cercanas a 32°C. Es razonable mantener el control térmico por objetivos durante al menos 24 horas después de alcanzar el objetivo deseado (recomendación AHA clase IIa, nivel de evidencia C-EO)14. No se recomienda el enfriamiento rutinario a nivel prehospitalario (recomendación AHA clase III, nivel de evidencia A para ausencia de beneficio). Después de completado el periodo propuesto de control térmico, no se conoce cuál es la estrategia óptima de manejo subsecuente de la temperatura. En todo caso, el recalentamiento debe ser lento y cuidadoso, siendo razonable prevenir activamente la fiebre (recomendación AHA clase IIb, nivel de evidencia C-LD)14.
El PALS 2015 de AHA recomienda las siguientes opciones como razonables para lactantes y niños comatosos después de PCEH: a) mantener 5 días de normotermia continua (36°C - 37.5°C); o, b) 2 días de hipotermia continua (32°C - 34°C) seguida de 3 días de normotermia continua (recomendación AHA clase IIa, nivel de evidencia B-R). El control de temperatura debe ser continuo (recomendación AHA clase I, nivel de evidencia BNR)14. En las guías 2015 de niños después de PCIH no se cita suficiente evidencia para recomendar la hipotermia26. Las actualizaciones 2019 de AHA precisan las recomendaciones para lactantes y niños con edad entre 24 horas y 18 años que permanecen comatosos después de PC e incluyen al PCIH. Se recomienda como posibilidades un control térmico por objetivos con temperatura de 32°C - 34°C seguida de 36°C - 37.5°C, o normotermia controlada de 36°C - 37.5°C (recomendación 2a, nivel de evidencia B-NR)14. En las guías 2020 de PALS no se ha colocado ningún cambio pero se clarifica la necesidad de mantener la temperatura corporal central por debajo de 37.5°C. No hay evidencia para recomendar una duración específica del tratamiento, pero cita el esquema del estudio TAPHCA15,25.
La implementación de la hipotermia controlada a 32 - 34°C puede dividirse en 3 fases: inducción, mantenimiento y recalentamiento. La inducción de la hipotermia se obtiene con diversos métodos: manta térmica servo-controlada, enfriamiento de superficie con hielo o baño frío, enfriamiento de la habitación, lavado gástrico con solución salina fría. El uso de infusiones de cristaloides fríos podría ser una opción, pero la administración de bolos rápidos incrementa el riesgo de bradicardia severa. Para ser efectiva, la temperatura objetivo debe obtenerse rápidamente, aunque el intervalo óptimo no se conoce.Se debe monitorizar en forma continua la temperatura central mediante sondas instaladas a nivel rectal, esofágico o vesical15. El mantenimiento de la temperatura entre 32 - 34°C requiere una monitorización cuidadosa para evitar fluctuaciones térmicas; en aproximadamente 15% de los pacientes se han encontrados temperaturas inferiores a 32°C y esto se ha asociado a mayor mortalidad.
La duración ideal de esta fase es desconocida, aunque 48 horas parece seguro. Tampoco se conoce el método ideal de recalentamiento. En general se prefiere no sobrepasar 0.5°C cada 2 horas para evitar los riesgos.
Los eventos adversos de la hipotermia pueden aparecer en las 3 fases descritas. Durante la inducción y el mantenimiento aparecen cambios hemodinámicos, metabólicos y electrolíticos, entre estos hipokalemia, hipofosfemia, hipomagnesemia e hipocalcemia, lo cual puede inducir arritmias. También pueden aparecer bradicardia e hipotensión, así como disminución de la sensibilidad a la insulina, trombocitopenia y disfunción inmunológica. El nivel sérico de amilasa puede elevarse, pero no se conoce su significado clínico. Durante el recalentamiento, sobre todo si es excesivamente rápido, puede aparecer hiperperfusión cerebral, edema vasogénico e hipotensión arterial15.
Recomendaciones LATAM de práctica diaria:
Estabilización de otras funciones orgánicas
Riñón
La función renal se puede dañar por la isquemia 2ria al paro y en esta fase de estabilización un bajo gasto cardíaco y la hipotensión persistentes son las causas de injuria más importantes. Su presencia ensombrece el pronóstico vital. Los factores de riesgo de presentación de formas severas son, en la evaluación post paro la presencia de creatinina elevada, antecedentes de enfermedad pulmonar crónica, paro intrahospitalario, reiteradas o altas dosis de adrenalina utilizadas en la reanimación, y la presencia acidosis. La presencia de un pH < 7.21 en las primeras 72 horas resultó un factor predictivo independiente de injuria renal aguda. La monitorización a través del ritmo diurético horario es un buen indicador, además los valores de azoemia y creatinina en sangre.
Los objetivos y metas terapéuticas son obtener un buen control hemodinámico. Una vez instalado la injuria hay que evitar la sobrecarga de volumen, ajustar la dosis de los fármacos y evitar los nefrotóxicos. Una vez instalado en fallo renal agudo, hay que establecer de acuerdo a escore su magnitud. De ser severo y/o no retomar ritmo diurético está indicada el tratamiento dialítico.
Hígado y órganos gastrointestinales
El flujo esplácnico es el último en normalizarse luego del paro. Por lo que el uso del tracto digestivo para nutrición se debe diferir para luego de asegurar una estabilidad hemodinámica permanente. El uso de inotrópicos y/o vasopresores no contraindican su reinicio. Como profilaxis de la úlcera de estrés está indicado ranitidina u omeprazol desde el inicio.
Control de glicemia
La glicemia es un parámetro de seguimiento seriado importante; debido al estrés inicial es frecuente encontrar hiperglicemias en lao primeros controles. Tanto en estudios en adultos como pediátricos no hay datos que permitan relacionar su control estricto con mortalidad, hay si una fuerte relación entre valores altos de glicemia y pobre resultados neurológicos.
El objetivo es normoglicemia. Evitar tanto la hiperglicemia como la hipoglicemia que puede llegar a ser más devastadora. Pero se observó que en rangos estrictos mayores riesgos de hipoglicemia e infecciones. El rango meta es 80 – 180 mg/ dl (control convencional). De presentar valores superiores y mantenidos estaría indicado iniciar un tratamiento con Insulina que revierta esos valores llevando a valores de rango metas superior.
Evaluación del pronóstico después del paro cardiaco:
Evaluación clínica:
La determinación del pronóstico es difícil y compleja después del PC en niños. Datos provenientes de una cohorte de 57 pacientes con EHI, 44 de éstos después de PC, mostraron que 3 características tienen un valor predictivo positivo de 100% para un pobre desenlace: a) Glasgow menor de 5; b) ausencia de respiración espontánea; y, c) ausencia de reflejo pupilar 24 horas después del retorno de la circulación espontánea1. El examen neurológico seriado por parte del mismo neurólogo contribuye a mejorar la certeza pronóstica. Sin embargo, el examen clínico tiene sus limitaciones y, por ello, muchas veces debe completarse la evaluación con métodos auxiliares.
Tabla 2. Factores pronósticos que se pueden observar antes o durante el paro cardiaco en niños.
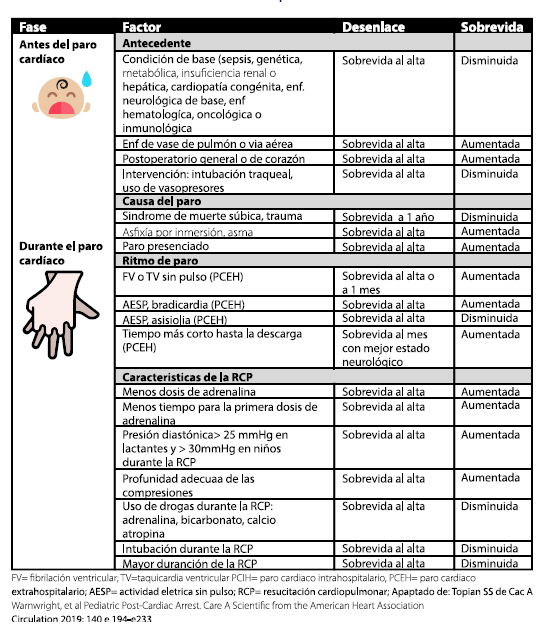
Si el niño ha recibido hipotermia controlada se requiere una aproximación más cautelosa; la concordancia entre neurólogos de la evaluación pronóstica mejora con el tiempo, siendo más certera si se realiza a los 5 – 7 días después del PC, en comparación con el día 1, o con los días 2 – 4 después del PC2. Lo más temprano que la evaluación clínica, en pacientes tratados con hipotermia controlada y que han recibido sedoanalgesia y relajación muscular, permite establecer una aproximación pronóstica, es a las 72 horas de restablecida la normotermia (recomendación AHA clase IIb, nivel de evidencia C-EO); si se usó normotermia, lo más temprano es 72 horas después del PC (recomendación AHA clase I, nivel de evidencia B-NR). El tiempo requerido puede ser mayor si se considera que existe un efecto residual de la sedoanalgesia o de la relajación muscular, efecto que puede confundir el examen neurológico (recomendación AHA IIa, nivel de evidencia C-LD). En la práctica, el tiempo usual hasta establecer un pronóstico suele ser 4 – 5 días, a menos que exista una enfermedad terminal de base, herniación cerebral franca o cualquier situación claramente no asociada con sobrevida3. Para que una prueba determinada tenga una fuerte validez pronóstica debe tener una sensibilidad de 100% y una tasa de falsos positivos de 0%4.
En pacientes comatosos en normotermia, la ausencia bilateral de reflejo pupilar a la luz a las 72 horas o más después de un PC permite predecir razonablemente un desenlace neurológico pobre con una tasa de falsos positivos de 0%, IC95% 0-8% (AHA clase IIa, nivel de evidencia B-NR). En un paciente tratado con hipotermia controlada, la tasa es de 1%, IC95% 0-3% (AHA clase I, nivel de evidencia B-NR)3. La ausencia bilateral de reflejo corneal a las 72 – 120 horas después del PC, predice un pronóstico pobre con una tasa de falsos positivos de 2%, IC95% 0-7%, pero no se recomienda su uso con fines pronósticos6.
La sensibilidad del examen de las pupilas y del reflejo corneal es baja, 19% para el examen pupilar, lo que significa que, entre los pacientes que tienen una mala evolución neurológica, solamente 1 de cada 5 tendrá pupilas fijas a las 72 horas4.
La evaluación de la función motora puede ser razonable para identificar los pacientes que requieren más pruebas con fines de pronóstico (AHA clase IIb, nivel de evidencia B-NR). Debido a su tasa alta de falsos positivos, la ausencia de movimientos en respuesta al dolor, la postura de extensión anormal, o la presencia de mioclonías, no deben ser usados como datos únicos para predecir el desenlace neurológico (AHA clase III para riesgo, nivel de evidencia B-NR). En cambio, la presencia de un estatus mioclónico (sacudidas musculares espasmódicas, espontáneas y continuas, con duración mayor a 30 minutos) durante las primeras 72 – 120 horas, en combinación con otras pruebas realizadas a partir de las 72 horas, permite establecer razonablemente un pobre pronóstico neurológico con tasa de falsos positivos de 0%, IC95% 0-4% (AHA clase IIa, nivel de evidencia B-NR)3.
EEG continuo: se usa para evaluar la función cortical y la presencia de actividad epileptiforme. Puede realizarse en forma seriada o continua, pero su interpretación requiere un clínico experimentado que conozca, además, la condición real del paciente, debido a que la presencia de hipotermia extrema (p.e. <33°C), edema del cuero cabelludo, colecciones extraaxiales, o el uso de medicamentos, pueden afectar la interpretación. Las guías PALS de AHA recomiendan que el EEG realizado dentro de los primeros 7 días después del paro puede considerarse con fines de pronóstico neurológico, pero no debe ser usado como criterio único sino en el contexto de otros elementos clínicos8.
Potenciales somato-sensoriales (PSS): pueden realizarse al lado de la cama del paciente, no se afecta por la sedación o hipotermia, y puede repetirse a intervalos. Los PSS evalúan la integridad del nervio periférico, médula espinal, tronco cerebral y corteza cerebral (onda N20). Existen muy pocos estudios en niños, pero la ausencia bilateral de la onda N20 en adultos a las 72 horas se asocia con mal pronóstico10. El mismo hallazgo, pero en niños comatosos por EIH 24 horas después del ingreso a la UCIP, tuvo 100% de valor predictivo positivo para mal pronóstico1. En niños no hay suficiente evidencia para recomendar el uso de PSS con fines de pronóstico9 Tomografía computada de cerebro (TC): la TC no contrastada es poco sensible si se realiza menos de 12 horas después del retorno de la circulación espontánea, aunque puede identificar los casos más severos de edema cerebral. Un estudio retrospectivo en niños mostró que una TC normal dentro de las primeras 24 horas después del retorno de la circulación espontánea se asoció con sobrevida (sensibilidad 62%, especificidad 90%) y desenlace neurológico favorable11. En cambio, la presencia de uno o más hallazgos patológicos (pérdida de la diferencia entre sustancia gris y blanca, borramiento de los surcos de la convexidad, colapso de las cisternas basales) se asoció con mayor mortalidad y peor pronóstico neurológico. La evolución desde una TC inicial normal a una anormal realizada con una diferencia mayor de 24 horas, también se asoció a pronóstico pobre11. En pacientes comatosos no tratados con hipotermia controlada, la presencia de una marcada reducción de la relación sustancia gris/sustancia blanca en una TC realizada 2 horas post-PC puede predecir razonablemente una pobre evolución (AHA clase IIb, nivel de evidencia B-NR)3.
Resonancia magnética de cerebro (RM): es más precisa que la TC por lo que la presencia de lesiones secundarias a hipoxia-isquemia (ganglios basales, corteza cerebral) se asocian a peor pronóstico. En particular, la presencia de restricción extensa en difusión en la RM realizada 2 – 6 días después del PC, en combinación con otros predictores, se asocia con una evolución neurológica pobre (AHA clase IIb, nivel de evidencia B-NR)3. Todavía no existe evidencia suficiente para plantear el pronóstico en base a cambios de la espectroscopía.
Flujo sanguíneo y oxigenación cerebral por NIRS (near infrared spectroscopy): los datos son muy limitados como para poder emitir recomendaciones.
Biomarcadores: la enolasa (neuron-specific enolase) es una enzima glicolítica que se libera desde el citoplasma de las neuronas. Debido a una tasa elevada de falsos positivos, el nivel plasmático de enolasa y de S-100B (una proteína ligadora de calcio en los astrocitos) no deben ser usados, como datos aislados, para predecir un pobre desenlace neurológico (AHA clase III para riesgo, nivel de evidencia C-LD)3. Un nivel elevado de enolasa 2 – 3 días después del PC, en conjunto con otras pruebas, podría sustentar un pronóstico neurológico pobre (AHA clase IIb, nivel de evidencia B-NR), en especial si muestras seriadas revelan niveles persistentemente elevados (AHA clase IIb, nivel de evidencia C-LD)3. Los niveles de estos biomarcadores pueden ser afectados por la hipotermia, por lo que su interpretación debe ser cuidadosa. La hiperlactacidemia después del PC no solamente refleja hipoperfusión sistémica sino también hipoperfusión cerebral. Concentraciones altas de lactato 12 horas después del PC se asocian con mortalidad incrementada y, en forma modesta, con peor evolución neurológica9.
Recomendaciones LATAM de práctica diaria:
La evaluación del pronóstico requiere un seguimiento clínico frecuente tomando en consideración el tiempo desde el PC, uso de medicación, y uso de hipotermia controlada.
La evaluación del pronóstico requiere la participación de un equipo multidisciplinario conformado por el intensivista, neurólogo, neurofisiólogo y neuroradiólogo.
La evaluación del pronóstico, diagnóstico de muerte encefálica y decisiones para pasar a cuidados de final de la vida deben tener en cuenta la legislación propia de cada país.
Conclusión
Ningún elemento pronóstico, por sí solo, tiene suficiente certeza pronóstica en niños después de PC. Al momento de establecer un pronóstico deben tenerse en cuenta todas las pruebas posibles y analizarlas en conjunto con los factores ocurridos antes y durante el PC.
REFERENCIAS BIBLIOGRÁFICAS
Dr. Mauricio Yunge
Intensivista pediátrico
Clínica las condes. Chile
https://orcid.org/0000-0003-3489-7736
Dr. Santiago Campos-Miño MD, MSc.
Pediatra Intensivista, Departamento de Pediatría y UCI Pediátrica,
Hospital Metropolitano
Quito, Ecuador
https://orcid.org/0000-0003-4686-7358
Dr. Bernado Alonso M.D.
Asistente de Clínica Pediátrica, Facultad Medicina
Universidad de la República Uruguay
https://orcid.org/0000-0002-0278-6647
Yunge M, Campos-Miño S, Alonso B. Cuidados sindrome postparo. Metro Ciencia [Internet]. 30 de agosto de 2021; 29(Supple1):49-63. https://doi.org/10.47464/MetroCiencia/vol29/supple1/2021/49-63