

Infección comunitaria del tracto urinario por Escherichia coli
en la era de resistencia antibiótica en Ecuador
Community urinary tract infection by Escherichia coli in the era of
antibiotic resistance in Ecuador
Recibido: 01-02-2021
Aceptado: 11-02-2022
Publicado: 31-03-2022
Revista MetroCiencia
Volumen 30, Número 1, 2022
Editorial Hospital Metropolitano
María Belén Solís1, Silvana Romo2, Mateo Granja1, Juan José Sarasti1, Ariane Paz y Miño1, Jeannete Zurita1,3
Las infecciones del tracto urinario (ITU) se encuentran entre las enfermedades infecciosas más frecuentes que afectan a los seres humanos y representan un importante problema de salud pública con una carga de morbilidad y de altos costos sanitarios especialmente cuando se complican. Los objetivos de este estudio son actualizar los patrones de resistencia a los antibióticos utilizados para las ITU causadas por E. coli comunitaria, comparar la resistencia antimicrobiana con otros datos publicados en Ecuador y sugerir varias estrategias para superar los desafíos que se presentan en el trabajo diario del laboratorio y la práctica clínica asociados con este importante problema. Resultados: Se aislaron 3341 Escherichia coli (79,38%), 299 Klebsiella pneumoniae (7,1%), 192 Enterococcus faecalis (4,56%), y otros microorganismos en el resto de muestras. Las alternativas de tratamiento empírico para E. coli son: nitrofurantoina, fosfomicina, amoxicilina/clavulanato, cefuroxima, ampicilina/sulbactam. E. coli productora de BLEE se encontró en 612 muestras (18,4%). Conclusión: es fundamental vigilar la resistencia bacteriana a nivel de comunidad, los datos obtenidos de la vigilancia hospitalaria no deben ser extrapolados a la comunidad.
Palabras clave: Infección del tracto urinario; comunidad; Escherichia coli; Resistencia antimicrobiana.
Urinary tract infections (UTIs) are among the most frequent infectious diseases that affect humans and represent a major public health problem with a burden of morbidity and high healthcare costs, especially when they are complicated. The objectives of this study are to update the patterns of resistance to antibiotics used for UTIs caused by community E. coli, to compare antimicrobial resistance with other data published in Ecuador, and to suggest various strategies to overcome the challenges that arise in daily work laboratory and clinical practice associated with this important problem. Results: 3341 Escherichia coli (79.38%), 299 Klebsiella pneumoniae (7.1%), 192 Enterococcus faecalis (4.56%), and other microorganisms were isolated from the rest of the samples. Empirical treatment alternatives for E. coli are: nitrofurantoin, fosfomycin, amoxicillin/clavulanate, cefuroxime, ampicillin/sulbactam. ESBL-producing E. coli was found in 612 samples (18.4%). Conclusion: it is essential to monitor bacterial resistance at the community level, the data obtained from hospital surveillance should not be extrapolated to the community.
Keywords: Urinary tract infection; community; Escherichia coli; antimicrobial resistance.
María Belén Solís
![]() https://orcid.org/0000-0003-3540-5609
https://orcid.org/0000-0003-3540-5609
Silvana Romo
 https://orcid.org/0000-0002-4422-6824
https://orcid.org/0000-0002-4422-6824
Mateo Granja
 https://orcid.org/0000-0002-3890-3796
https://orcid.org/0000-0002-3890-3796
Juan José Sarasti
![]() https://orcid.org/0000-0003-2915-2422
https://orcid.org/0000-0003-2915-2422
Ariane Paz y Miño
![]() https://orcid.org/0000-0002-2579-7488
https://orcid.org/0000-0002-2579-7488
Jeannete Zurita
![]() https://orcid.org/0000-0002-9935-2588
https://orcid.org/0000-0002-9935-2588
 |
Este artículo está bajo una licencia de Creative Commons de tipo Reconocimiento – No comercial – Sin obras derivadas 4.0 International. |
*Correspondencia:jzurita@zuritalaboratorios.com
Las infecciones del tracto urinario (ITU) se encuentran entre las enfermedades infecciosas más frecuentes que afectan a los seres humanos en ambos sexos y representan un importante problema de salud pública con una carga de morbilidad y de altos costos sanitarios especialmente cuando se complican [1]. Las consultas por infecciones urinarias representan entre el 1% y el 6% de todas las visitas médicas (alrededor de 7 millones de visitas y aproximadamente US $1600 millones anuales) en los Estados Unidos [2]. La ITU causada por bacterias Gram negativas es la segunda infección en la práctica médica comunitaria. Aproximadamente 150 millones de personas son diagnosticadas con ITU cada año, lo cual representa una carga enorme de uso de antimicrobianos [3]. Hasta el 15% de los antibióticos recetados en la comunidad se deben a ITU [4]. Teniendo en cuenta estos datos, existe un mayor riesgo de resistencia a los antibióticos. Probablemente su frecuencia y carga deben ser más altas de las que sugieren los datos disponibles porque la ITU no se encuentra dentro de las enfermedades de notificación obligatoria [5].
Debido al alto uso de antibióticos para el tratamiento de la ITU, la resistencia antibacteriana, específicamente en los principales uropatógenos como E. coli ha aumentado significativamente en todo el mundo [1]. Son varios los factores que han contribuido a este aumento y por esto la vigilancia de resistencias bacterianas de uropatógenos es indispensable. Hay varios sistemas de vigilancia sorbre resistencia bacteriana en uropatógenos. En el Ecuador, la mayoría de hospitales recopila sus datos en la cartilla anual que alimenta al Sistema Nacional de Resistencia a los Antimicrobianos y este a su vez alimenta en América Latina al sistema Red Latinoamericana de Vigilancia de Resistencia a los Antimicrobianos (ReLAVRA [6,7]. Estos sistemas son valiosos para el conocimiento de los datos locales y regionales de susceptibilidad antibiótica pues permiten seleccionar los antibióticos empíricos adecuados y evitar el uso de tratamientos tóxicos o más costosos.
Los objetivos de este estudio son actualizar los patrones de resistencia a los antibióticos de E. coli aislada de ITU comunitaria del año 2020, especialmente con respecto a los antibióticos orales, comparar con otros datos de resistencia publicados en Ecuador y sugerir varias estrategias para superar los desafíos que se presentan en el trabajo diario del laboratorio y la práctica clínica asociados con este importante problema.
Es un estudio descriptivo, observacional y retrospectivo. Se analizaron los datos obtenidos de los urocultivos procesados a libre demanda de un laboratorio privado de la ciudad de Quito (Zurita&Zurita Laboratorios) de enero a diciembre del año 2020. Se recolectaron los informes de los problemas más frecuentes en los urocultivos. Estos fueron sembrados en CHROMagarTM Orientación (Figura 1). Los datos generados en el año 2020 fueron obtenidos del software WHONET. Las pruebas de susceptibilidad a los antibióticos se realizaron por el método de difusión por disco Kirby-Bauer utilizando los antibióticos recomendados para infección de vías urinarias tales como amikacina, nitrofurantoína, fosfomicina, amoxicilina-clavulanato, gentamicina, cefalotina, cefuroxima, ampicilina-sulbactam, ciprofloxacino, tetraciclina, trimetoprima-sulfametoxazol, ampicilina. Los puntos de corte se analizaron de acuerdo a los valores de referencia reportados en el CLSI 2020 [8].
Se realizó una búsqueda sistemática para obtener información en relación con resistencia a los antibióticos de E. coli comunitaria en ITU. Para ello se utilizaron palabras claves: Escherichia coli, comunitario, resistencia antimicrobiana, infección de vías urinarias, Ecuador, en español e inglés en Pubmed y Google Scholar. Se escogieron tres estudios, el resto fue descartado debido a que eran datos de ámbito hospitalario, en su mayoría era sobre prevalencia de las enzimas betalactamasas de expectro extendido (BLEE), el número de aislamientos no era significativo o las publicaciones se hicieron antes del año 2016. Los tres estudios seleccionados para la comparación corresponden a datos de la parte ambulatoria de un hospital privado, Hospital de los Valles (HDLV) [9], datos de una población nativa amerindia kichwa, realizado por Guamán y cols., al que denominamos NATIVA [10] y los datos publicados por el centro nacional de referencia del Ecuador (INSPI) [7].
Durante el período comprendido entre enero y diciembre de 2020, se cultivaron un total de 9 831 urocultivos, de los cuales fueron negativos 4488 (45,65 %), positivos con recuentos >100 000 ufc/ml fueron 4209 (42,81%), y flora mixta fueron 1 134 (11,53%).
Las bacterias aisladas en este grupo de pacientes fueron 3 341 Escherichia coli (79,38%), 299 Klebsiella pneumoniae (7,1%), 192 Enterococcus faecalis (4,56%), 118 Proteus mirabilis (2,8%), 56 Enterobacter cloacae (1,33%), 47 Staphylococcus saprophyticus (1,12%), 43 Staphylococcus epidermidis (1,02%), 44 Streptococcus beta grupo b (1,05%), 17 Morganella morgani (0,4%), 10 Citrobacter freundii (0,24%), 2 Salmonella ssp (0,05%) y el resto 40 corresponden a otros uropatógenos (0,95%). De los 3 341 positivos para E. coli, 3 069 (91,8%) corresponden a mujeres y 272 (8,2%) a hombres en una población comprendida entre los 0-102 años con una media de edad de 47 años +/- 3.58 DE.
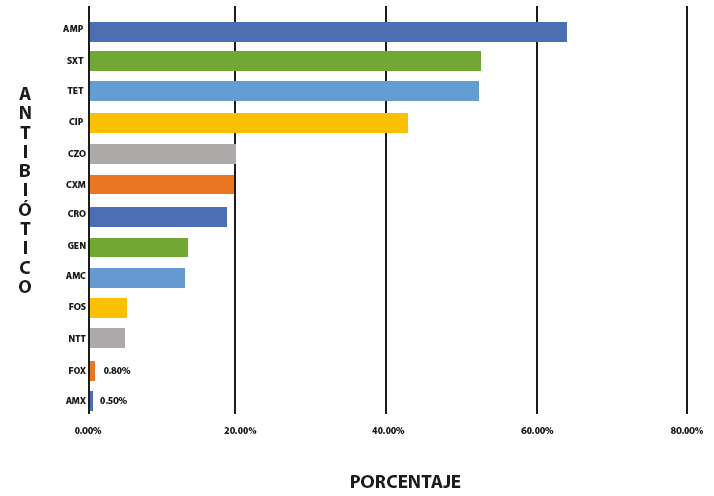
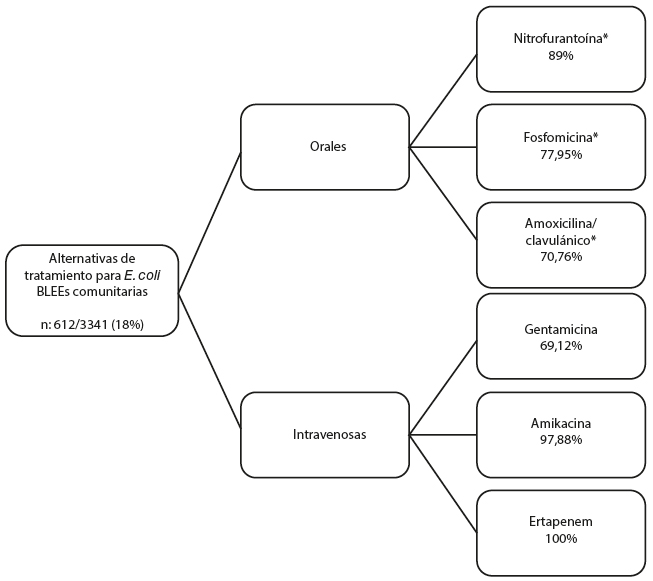
De 1 mes a 14 años se encontraron urocultivos positivos para E. coli en 451 (13%) pacientes, de 15 a 60 años fueron 1 740 (52%), y los mayores a 60 años fueron 1 150 (35%) pacientes. Los datos de resistencia a los diferentes antibióticos se encuentran en la figura 2. E. coli productora de BLEE se encontró en 612 muestras (18,31%). En la figura 3 se resume las alterativas de tratamiento para BLEE a nivel comunitario.
De acuerdo con los datos de Sistema Nacional de Vigilancia RAM [7], la resistencia antibiótica en ITU de la comunidad para los antibióticos como gentamicina, ampicilina, amoxicilina-clavulánico, cefalotina, trimetoprima-sulfametoxazol, ciprofloxacina es mayor al 20%. La resistencia a cefuroxima es de 29,9%. No reportan datos de fosfomicina ni ceftriaxona. La figura 4 muestra los resultados de esta vigilancia nacional [7] en comparación con otros dos estudios comunitarios [9,10] y el nuestro. A pesar que el CLSI indica los antibióticos que deberían ser probados y reportados, en los estudios seleccionados no se ensayan los mismos antibióticos.
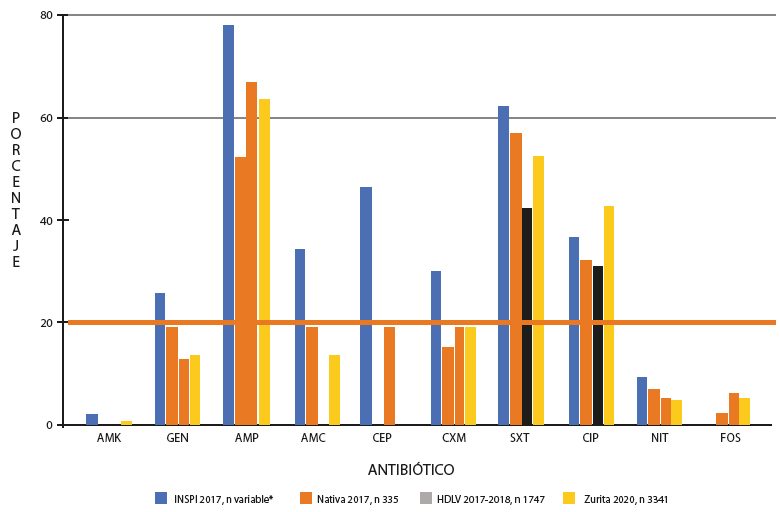
*variable= el número de cepas difiere con el antibiótico testado n= 39 hasta 4 527.
La orina es normalmente estéril, pero se puede contaminar por bacterias de la piel o los genitales, por lo que es muy importante antes de tomar la muestra que tanto hombres como mujeres se laven bien sus genitales y zonas adyacentes. Sin embargo, esta recomendación la mayoría de veces no se cumple, lo que puede conducir a una falsa ITU. Esto sucede sobre todo en niños y adultos mayores ocasionando un uso indiscriminado de antibióticos [11]. En este estudio se encontró un 11% de urocultivos con flora mixta que refleja un mal proceso preanalítico; es decir, contaminación. En la práctica clínica el interpretar cultivos de flora mixta como negativos es apropiado [12]. El 45,65% fueron urocultivos negativos. La disuria es una causa importante de consulta y es un síntoma que en la mayoría de las veces se asocia con ITU, por lo que los pacientes pueden recibir antibióticos sin que se documente la infección (o sin que se haya confirmado la infección) [13]. La limitación de este estudio es que no relacionó, pacientes que presentaron disuria con un urocultivo negativo. De todas maneras, es importante recalcar que la disuria no es sinónimo de ITU porque puede ser causada por cálculos en la vejiga o renales, cistitis de origen no infeccioso, infección de trasmisión sexual, prostatitis, uretritis, estenosis uretral, vaginitis, candidiasis vaginal, y el uso de jabones, perfumes y otros productos de cuidado personal [14]. Adicionalmente Kayap y cols., concluyeron que solo el 2.3% de urocultivos solicitados son positivos lo cual resulta en un exceso innecesario de solicitud de urocultivos [15]. Para evitar este exceso ahora se cuenta con la citometría de flujo de orina que puede dar resultados en forma rápida (evitando las 48 horas del urocultivo) y excluir ITU utilizando un número determinado de bacterias. Por lo tanto, se pueden obtener resultados rápidos, precisos y de bajo costo al realizar un elemental y microscópico de orina (EMO) con esta metodología [16]. Debido a que hay una reducción significativa en el tiempo de respuesta (105 muestras por hora) [17], la prescripción antibiótica empírica innecesaria también se reduce al conocer en tan poco tiempo que la muestra es negativa para bacterias. Debido al impacto social y económico de esta metodología en la prescripción antibiótica, se debería considerar incorporar la citometría de flujo en el proceso de interpretación estándar actual, apoyando la toma de decisiones de los microbiólogos [18].
Este estudio no evaluó la bacteriuria asintomática, sin embargo, es importante señalar que es una causa bien conocida de prescripción innecesaria de antitiótico, así como de solicitudes recurrentes de urocultivos. En general, la bacteriuria asintomática no requiere el uso de antibióticos y se debe considerar el tratamiento en niños menores de 5 años, embarazadas, inmunodeprimidos, alteraciones de la vía urinaria, antes o después de cirugía urología-prostática, previo a una manipulación urológica mayor, mujeres en las que realizó sondaje vesical y si la bacteriuria persiste 48 horas después de retirada la sonda [19]. En este sentido, actualmente existe evidencia para considerar que la bacteriuria asintomática podría tener un efecto protector frente al desarrollo de ITU sintomática posterior por competencia entre distintas cepas o especies [20].
Las muestras fueron sembradas en CHROMOagar Orientación. Este agar tiene varias ventajas sobre los medios tradicionales, pues permite en la mayoría de los casos diferenciar en forma confiable algunas especies de patógenos del tracto urinario basada en una paleta de colores [21]. La diferenciación por colores de las colonias permite un reconocimiento más fácil de crecimiento de flora mixta y proporciona tasas de detección más altas (Figura 1). Las ventajas de esta técnica es que permite ahorrar tiempo, reduce la carga de trabajo y optimiza el espacio en las estufas [22]. Una caja petri de CHROMOagar proporciona la misma información que la combinación de cajas clásicas utilizadas para la siembra de orinas [23]. Se recalca que no está indicado la siembra de orina en cajas de cuatro cuadrantes o en bi-Petri, pues no se puede realizar el recuento semicuantitativo de colonias ni tampoco distinguir el tipo de colonias.
De acuerdo con la recomendación “Qué NO hacer en Microbiología” de la Agencia Española de Medicamentos y productos sanitarios (AEMPS) [24], es suficiente para el manejo de la ITU en atención primaria un antibiograma realizado mediante el método de difusión con disco o Kirby Bauer. No se recomienda hacer CIM (concentración inhibitoria mínima) porque este método orienta al clínico sobre la concentración de antibiótico que se debe alcanzar en el sitio de la infección para inhibir el microorganismo infectante y es bien conocido que el antibiótico alcanza en vías urinarias bajas concentraciones de hasta 6 o más veces que en el suero [25]. Sin embargo, la selección de la metodología es una decisión de cada laboratorio. De acuerdo con los documentos del año 2022 del CLSI y el EUCAST, las pruebas de sensibilidad con disco siguen vigentes, son recomendables para muestras obtenidas de la comunidad y son menos costosas que realizar CIM [8,26].
En este estudio el principal agente etiológico de ITU identificado fue la E. coli con un 79% seguido por Klebsiella spp (7%) y Proteus mirabilis (2,8%) como se describe en otras revisiones [27,28]. La prevalencia de ITU fue mayor en mujeres, representando un 91%, debido a factores de riesgo como el embarazo, cambio de pH de la orina, atrofia urogenital en la menopausia y por la colonización de la uretra por enterobacterias por las condiciones anatómicas [5].
La vigilancia de resistencia a los antimicrobianos tiene como objetivo establecer un tratamiento empírico apropiado; es decir, que se puede iniciar un tratamiento antibiótico sin la necesidad de hacer un urocultivo o si se decide hacerlo no empezar con la terapia empírica hasta tener el resultado del urocultivo, esto conlleva a disminuir el riesgo de complicaciones o de fracaso terapéutico. En el caso de ITU el tratamiento empírico se puede iniciar cuando la resistencia no llega al 20%. Esto difiere en el caso de infecciones sistémicas donde se considera tratamiento empírico cuando la resistencia es menor al 10% [29]. De acuerdo con nuestros hallazgos las alternativas de tratamiento empírico o inicio de tratamiento hasta obtener los datos del antibiograma son: nitrofurantoína, fosfomicina, amoxicilina/clavulanato, cefuroxima, (Figura 2).
El tratamiento gold estándar para ITU no complicada es trimetoprima-sulfametoxazol seguido de quinolonas como ciprofloxacino u ofloxacino, también se recomienda fosfomicina y nitrofurantoína (cuando la resistencia es menor al 20%). Con estos dos últimos se obtienen los mismos resultados, con un número reducido de efectos adversos y menor costo. En este estudio la tasa de resistencia a E. coli a quinolonas fue del 42.6% y para trimetroprima-sulfametoxazol fue del 52.3%. Al superar el 20% de resistencia antibiótica, significa que estos antibióticos no pueden ser usados como tratamiento empírico. En otros países estos dos antibióticos siguen siendo considerados como tratamiento empírico debido a que tienen un porcentaje de resistencia menor del 20%, lo que refleja la importancia de la vigilancia a nivel nacional y local [30].
De acuerdo con los datos de este estudio las alternativas de tratamiento por vía oral de E. coli urinaria productora de BLEE son varias, como se puede observar en la Figura 3. Sin embargo, en otros estudios [30], apenas son alternativas de tratamiento fosfomicina y nitrofurantoína. La presencia de esta enzima BLEE en E. coli causante de ITU de la comunidad fue del 18% contrastando con otros estudios ecuatorianos que arrojan cifras mayores al 30% de E. coli BLEE [31].
En relación con el antibiótico ampicilina hay diferencia estadísticamente significativa entre las 4 bases de datos analizadas, p=0,003. En cuanto al antibiótico amoxicilina/ácido clavulánico, existe diferencia estadísticamente significativa entre las bases analizadas, INSPI 2.017, NATIVA 2.017 y Zurita 2.020, p=0.001 y finalmente, existe diferencia estadísticamente significativa entre las bases INSPI 2.017 y HDLV 2.017, en cuanto a la resistencia bacteriana al antibiótico cefalotina, p= 0,001, con el resto de los antibióticos evaluados, no se apareció diferencias en cuanto a la respuesta antibiótica
Debido a que las bacterias productoras de betalactamasa de espectro extendido (BLEE) hoy en día causan muchas infecciones en el entorno comunitario, la comunidad médica depende cada vez más de la vigilancia microbiana multinivel para informar las decisiones de tratamiento, identificar problemas importantes y orientar las medidas de control adecuadas [32]. El conocimiento de los datos regionales de susceptibilidad con respecto a E. coli (antibiogramas) es muy importante para seleccionar el tratamiento empírico adecuado, así como la vigilancia permanente de RAM ya que a la velocidad con la cual las cepas de E. coli se vuelven resistentes aumenta en forma vertiginosa en todo el mundo gracias a los genes, plásmidos, transposones que pueden transferirse entre bacterias incluso entre especies. La mayoría de sistemas de vigilancia se basan en datos hospitalarios y la recopilación de datos ambulatorios en muestras de pacientes que acuden a la consulta externa y emergencia de esos hospitales, por lo que podrían los datos obtenidos de esta forma no representan a los aislamientos comunitarios de forma acertada.
La vigilancia de resistencia es una tarea muy importante y compromiso de todos, por lo cual se debe proporcionar datos fidedignos para un buen manejo de infecciones y para prevenir la aparición de resistencia antimicrobiana debido al mal uso de los mismos [32]. La tecnología ha mejorado enormemente el conocimiento de datos. A pesar de que esta tecnología está diseñada para funcionar de manera efectiva, los errores aún ocurren [33]. Es importante dedicar un gran porcentaje de tiempo en preparar la información, debido a que sin datos limpios y confiables es imposible llevar a cabo una estrategia en salud y lamentablemente si los datos no están depurados habrá que invertir la misma cantidad de recursos en interpretarlos para poder resolver problemas y plantear nuevas estrategias [34].
Es fundamental vigilar la resistencia bacteriana a nivel de comunidad, los datos obtenidos de la vigilancia hospitalaria no deben ser extrapolados a la comunidad.
E. coli productora de BLEE en la comunidad es del 18% en este estudio.
E. coli productora de BLEE secreta beta-lactamasas que pueden conferir resistencia a penicilinas, cefalosporinas y aztreonam, pero que son inhibidos por los inhibidores de la beta-lactamasa, por lo tanto, exhiben una buena actividad in vitro como en amoxicilina-ácido clavulánico, piperacilina-tazobactam contra E. coli productora de la BLEE sobre todo del tipo CTX-M. Estos inhibidores de la beta-lactamasa no deben utilizarse en infecciones sistémicas y bacteriemias porque se ha demostrado falla de tratamiento. En el contexto del aumento de la prevalencia de BLEE a escala mundial, el uso empírico por vía oral de amoxicilina/clavulánico en IVU es cuestionable. Además, que es controversial su uso en infecciones urinarias con invasión del torrente circulatorio.
Limitaciones del estudio
Las limitaciones de nuestro estudio fueron: no se realizaron comparaciones en el mismo año debido a que no se encontraron estudios publicados y realizados en el 2020, los últimos publicados fueron del 2017. En los estudios analizados no se ensayan los mismos antibióticos, por lo que en algunos de ellos no se pudo realizar la comparación a pesar que las diversas instituciones reguladoras indican cuáles antibióticos deberían ser ensayados. El número de E. coli estudiadas es variable en los cuatro estudios analizados.
Contribución de los autores
a) Concepción y diseño del trabajo: Jeannete Zurita,
b) Recolección de datos e ingreso al Whonet: Silvana Romo, Mateo Granja, Juan José Sarasti
c) Análisis e interpretación de datos y estadística: María Belén Solís
d) Redacción del manuscrito: María Belén Solís, Jeannete Zurita.
e) Revisión crítica del manuscrito: María Belén Solís, Arianne Paz y Miño, Jeannete Zurita.
f) Aprobación de su versión final: Jeannete Zurita.
g) Aporte de pacientes o material de estudio: Zurita& Zurita Laboratorios.
Conflicto de interés
Los autores no presentan conflicto alguno.
Financiamiento
No se requirió financiamiento.
Agradecimientos
Agradecemos a Cecibel González, Carolina Alulema y Leidys Guillén del área de Microbiología por su apoyo técnico en la realización de los urocultivos. A Betzabé Tello por la revisión del manuscrito y a José Gregorio Chacón Alvarez por el análisis estadistico.
CITAR ESTE ARTÍCULO:
Solís MB, Romo S, Granja M, Sarasti JJ, Paz y Miño A, Zurita J. Infección comunitaria del tracto urinario por Escherichia coli en la era de resistencia antibiótica en Ecuador. Metro Ciencia [Internet]. 30 de marzo de 2022; 30(1):37-48. https://doi.org/10.47464/MetroCiencia/vol30/1/2022/37-48
MetroCiencia VOL. 30 Nº 1 (2022)