

 , Md. María José Molestina2
, Md. María José Molestina2 ,
,  , Md. Adriana Estefanía Pauker Álvarez4
, Md. Adriana Estefanía Pauker Álvarez4
Especialista en Medicina Interna; Doctor en Medicina y Cirugía; Médico Internista, Hospital Pablo Arturo Suárez; Quito, Ecuador1;
Especialista en Medicina Interna; Médico Internista del Hospital Pablo Arturo Suárez; Quito, Ecuador2;
R2 Posgrado de Medicina Interna de la Pontificia Universidad Católica del Ecuador; Doctor en Medicina; Hospital Metropolitano; Quito, Ecuador3;
Médico General; Investigador Independiente; Quito, Ecuador4.
Se presenta el caso de un paciente diabético de 55 años de edad internado en la sala de Medicina Interna del Hospital Pablo Arturo Suárez de Quito - Ecuador, que acude con un síndrome febril de 8 días de evolución que se prolongó durante la hospitalización a más de 35 días sin causa o foco aparente, a pesar del tratamiento antipirético, acompañado de dolor abdominal difuso, pérdida de peso (aproximadamente 8 kg en 3 meses) y ascitis. Se investigó las posibles etiologías, incluyendo pruebas de alta sensibilidad y especificidad para tuberculosis como (Cuantiferon GOLD Tb), adenosina deaminasa (ADA), que resultó falsa-negativa. El diagnóstico se confirmó mediante biopsia peritoneal de una muestra obtenida por laparoscopia exploratoria como último recurso diagnóstico. La tuberculosis peritoneal es una enfermedad que ocurre por la reactivación de los focos tuberculosos latentes en el peritoneo, debido a la diseminación hematógena, linfática o por contigüidad a un foco primario; más del 90% de los pacientes tienen ascitis en el momento de la presentación y un 10% presenta una fase “seca” más avanzada con un abdomen “pastoso” (es una forma de enfermedad fibroadhesiva).
Palabras claves: tuberculosis peritoneal, ascitis, síndrome febril prolongado, biopsia peritoneal, falsos negativos en pruebas diagnósticas de tuberculosis.
The case of a diabetic patient of 55 years of age is presented in the internal medical room of Pablo Arturo Suarez Hospital of Quito - Ecuador, the same comes with a febril syndrome of 8 days of evolution that prolonged during the hospitalization to more of 35 days without cause or apparent focus despite the antipyretic treatment, accompanied by diffuse abdominal pain, weight loss and ascitis, where the possible etiologies were investigated, including tests of high sensitivity and specificity for tuberculosis as (quantiferon), resulting false negative, confirming the diagnosis through peritoneal biopsy of a sample obtained by exploratory laparoscopy as a last diagnostic resource. Peritoneal tuberculosis is a disease that occurs by the reactivation of latent tuberculosous focus in the peritoneum, established by hematogen, lymphatic or contiguous dissemination of a primary focus, where more than 90% of patients have ascitis at the time of presentation, and a 10% present a more advanced “dry” phase with a “pastoso” abdomen, representing a form of fibroadhesive disease.
Keywords: peritoneal tuberculosis, ascites, prolonged febrile syndrome peritoneal biopsy, false negatives in diagnostic tests for tuberculosis.
| IDs Orcid | |
| Yuan Leonel Kuonqui Vera: | https://orcid.org/0000-0003-2174-1409 |
| María José Molestina: | https://orcid.org/0000-0003-1640-1522 |
| Miguel Alejandro Calvo González: | https://orcid.org/0000-0001-6888-4082 |
| Adriana Estefanía Pauker Álvarez: | https://orcid.org/0000-0002-3052-6033 |
INTRODUCCIÓN
La tuberculosis abdominal es una enfermedad re-emergente. La primera referencia de posible tuberculosis pulmonar fue en 1643 cuando la autopsia de Luis XIII mostró unas lesiones intestinales ulcerativas asociadas con una gran cavidad pulmonar. Con el paso de los años y el uso de medicamentos efectivos contra el Mycobacterium tuberculosis, en los países desarrollados cambió el patrón de presentación a una mayor prevalencia de las formas extrapulmonares que incluían la tuberculosis abdominal1.
Aproximadamente 1 a 3% del total de casos son extrapulmonares, de los cuales 11 a 16% son de tuberculosis abdominal1, que ocurre por la reactivación de los focos tuberculosos peritoneales latentes, establecidos por diseminación hematógena, linfática o contiguo de un foco primario1.
Es menos frecuente que las infecciones por micobacterias (Mycobacterium bovis) entren a la cavidad peritoneal por vía transmural desde el intestino delgado infectado (por ingestión de leche no pasteurizada o carne mal cocida).
En la enfermedad avanzada, el peritoneo se encuentra tachonado de tubérculos que exudan líquido proteináceo y hay ascitis.
Factores de riesgo
Cirrosis hepática, infección por VIH, diabetes mellitus, malignidad subyacente, tratamiento con agentes antitumorales del factor de necrosis (TNF) y diálisis peritoneal.
Formas clínicas de la enfermedad
La Tb abdominal puede presentarse en cualquiera de los siguientes sitios: peritoneo, esófago, estómago, tracto intestinal, árbol hepatobiliar, páncreas, área perianal y ganglios linfáticos. Las formas más comunes se localizan en el peritoneo, intestino o hígado.
La Tb abdominal puede producirse como consecuencia de la reactivación de una infección latente de tuberculosis o por ingestión de micobacterias tuberculosas (como ocurre con la ingestión de leche no pasteurizada o de carne mal cocida). En el contexto de Tb pulmonar activa o Tb miliar, la afectación abdominal puede ocurrir por diseminación hematógena mediante la propagación contigua de la Tb de órganos adyacentes (v.gr.: propagación retrógrada de las trompas de Falopio) o a través de los canales linfáticos2.
En general, las manifestaciones sintomáticas de la Tb abdominal dependen de la forma de la enfermedad y pueden incluir fiebre, pérdida de peso, dolor abdominal y/o distensión, ascitis, hepatomegalia, diarrea y masa abdominal3. Los problemas adicionales relacionados con las manifestaciones sintomáticas se tratan en las siguientes secciones.
Las pruebas de laboratorio de rutina demuestran anemia leve y aumento de la tasa de sedimentación en 50 a 80% de los pacientes; el recuento de glóbulos blancos suele ser normal4. Aproximadamente, 15 a 25% de pacientes con Tb abdominal tienen Tb pulmonar concomitante2.
La Tb peritoneal ocurre con mayor frecuencia después de la reactivación de los focos tuberculosos latentes en el peritoneo mediante la diseminación hematógena de un foco primario pulmonar5. La peritonitis tuberculosa también puede ocurrir a través de diseminación hematógena de la Tb pulmonar activa o de la Tb miliar. Con mucha menos frecuencia, las mycobacterias tuberculosas ingresan en la cavidad peritoneal por vía transmural desde el intestino delgado infectado o por propagación contigua de salpingitis tuberculosa6. A medida que avanza la enfermedad, el peritoneo visceral y parietal va tachonándose de tubérculos. La ascitis es secundaria a la exudación del fluido proteináceo de los tubérculos.
Manifestaciones clínicas
10% de los casos presenta una fase “seca” más avanzada asociada con un abdomen “pastoso”; es una forma de enfermedad fibroadhesiva8,9.
La ausencia de signos de enfermedad hepática crónica (como eritema palmar, angiomas de araña y venas de la pared abdominal dilatada) debería aumentar la sospecha de peritonitis tuberculosa8,9.
Más del 90% de pacientes con peritonitis tuberculosa tienen ascitis en el momento de la presentación, con un gradiente de albúmina sérica-ascitis (GASA) < 1,1 g / dl (en ausencia de cirrosis)10.
En los pacientes con insuficiencia renal en diálisis peritoneal ambulatoria continua (CAPD), las manifestaciones de la peritonitis tuberculosa se desarrollan típicamente en el primer año de inicio de la CAPD y, generalmente, son indistinguibles de la peritonitis bacteriana8,9.
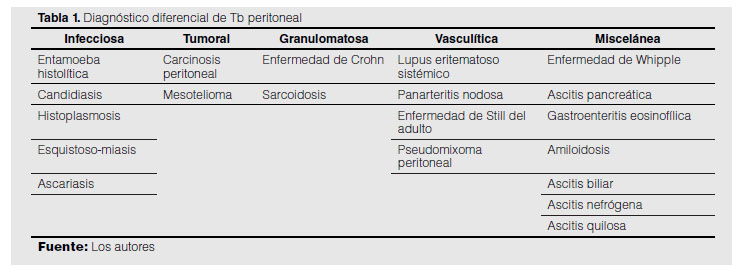
Diagnóstico
Enfoque clínico
Debe sospecharse tuberculosis abdominal en los pacientes con manifestaciones sintomáticas relevantes (fiebre, pérdida de peso, dolor abdominal y/o distensión, ascitis, hepatomegalia, diarrea, masa abdominal, pruebas de función hepática anormales) y cuando hay factores epidemiológicos relevantes (antecedente de infección o enfermedad tuberculosa, exposición conocida o posible a tuberculosis y/o residencia pasada o presente en un área de tuberculosis endémica).
El diagnóstico definitivo se establece mediante la demostración del Mycobacterium tuberculosis en el fluido peritoneal (cuando hay ascitis) o en una muestra de biopsia de un sitio afectado (peritoneo, intestino o hígado) o por cultivos mycobacterianos y/o prueba de amplificación de ácido nucleico (NAAT)11,12.
En ausencia de ascitis, se debe realizar una biopsia. La elección del sitio de la biopsia debe guiarse por el alcance de la afectación anatómica demostrada en las imágenes radiográficas. El enfoque para obtener muestras de biopsia debe adaptarse a las circunstancias individuales; incluye el sitio dominante de participación y los riesgos y beneficios asociados. Por ejemplo, en la afectación intestinal debe obtenerse biopsias endoscópicas; en la hepática aislada se debe realizarse biopsia de hígado. Todas las muestras diagnósticas deben enviarse para realizar estudio histopatológico, cultivo de mycobacterias y pruebas de sensibilidad a los medicamentos.
En general, el análisis diagnóstico de ascitis permite establecer una Tb abdominal en los pacientes inmunocompetentes. En cambio, en los inmunocomprometidos, aumenta la probabilidad de que haya más de una afección. Por lo tanto, en estos pacientes se puede justificar la recolección de muestras para diagnóstico de cada sitio de la enfermedad; el enfoque debe adaptarse a las circunstancias individuales y a la evaluación de riesgos y beneficios.
Podría no ser posible establecer el diagnóstico definitivo de tuberculosis abdominal. Los pacientes con probable tuberculosis abdominal son aquellos con cultivo micobacteriano no diagnóstico y resultados de NAAT asociados con ADA en líquido ascítico elevado y/o hallazgos constantes en histología, con exclusión de otros elementos de diagnóstico diferencial.
Imagen radiográfica: la tomografía computarizada es la modalidad de imagen más útil para evaluar la tuberculosis abdominal13-14:
En la Tb intestinal es más común el engrosamiento mural concéntrico de la región ileocecal, con o sin dilatación intestinal proximal15. Ocasionalmente, se observa engrosamiento asimétrico de la pared cecal medial. Puede haber linfadenopatía con centros hipodensos (representan licuefacción caseosa) en el mesenterio adyacente; también muestra ascitis, ganglios linfáticos, engrosamiento del mesenterio y omento, y engrosamiento del peritoneo16.
En la Tb hepática depende de que el paciente padezca de Tb hepática miliar o Tb hepática local. La tomografía computarizada en la enfermedad miliar muestra múltiples micronódulos de baja densidad dispersos por todo el hígado; también puede mostrar hepatomegalia sin lesiones intrahepáticas ni linfadenopatía abdominal con aumento de los ganglios linfáticos periféricos y/o calcificaciones11,17.
La tomografía computarizada en la Tb hepática local muestra un gran nódulo solitario o de 2 a 3 nódulos de baja densidad con calcificación y realce periférico.
La ecografía es útil para detectar linfadenopatía, ascitis, engrosamiento peritoneal, engrosamiento omental y engrosamiento de la pared intestinal15,18.
El seguimiento del intestino delgado o el enema de bario pueden mostrar úlceras y constricciones de la mucosa, ciego deformado y/o una válvula ileocecal incompetente18.
La radiografía simple puede mostrar niveles hidroaéreos en el intestino delgado dilatado (sugieren obstrucción intestinal) o calcificaciones hepáticas11.
El diagnóstico de Tb abdominal se estable definitivamente mediante la demostración de Mycobacterium tuberculosis en el líquido peritoneal (cuando hay ascitis) o mediante una muestra de biopsia de un sitio afectado (peritoneo, intestino o hígado) o mediante cultivo de micobacterias y/o prueba de amplificación de ácido nucleicos.
Los pacientes sospechosos de Tb abdominal deben someterse a estudios radiográficos; la tomografía computarizada (TC) es preferible, cuando es factible, porque permite evaluar la afectación del hígado y otros órganos, así como ascitis, afectación peritoneal y linfadenopatía. Los pacientes con ascitis deben someterse a paracentesis. El líquido debe enviarse para pruebas de rutina (recuento celular y diferencial, concentración de albúmina y proteína, tinción de Gram), así como para determinar el nivel de adenosina-desaminasa (ADA), bacilos ácido-rápido (AFB), cultivo de micobacterias y prueba de amplificación de ácido nucleicos (NAAT) para Mycobacterium tuberculosis. Los pacientes con peritonitis tuberculosa (en ausencia de cirrosis subyacente) suelen tener ascitis linfocítica con gradiente de albúmina de suero y ascitis (SAAG) < 1,1 g / dl. Un nivel elevado de ascitis ADA (30 a 39 UI/L) es útil para respaldar el diagnóstico de Tb en pacientes no cirróticos, aunque no lo establece con certeza. Los pacientes cuyo análisis de ascitis no es determinante del diagnóstico deben someterse a biopsia peritoneal mediante laparoscopia.
Obtención de muestras de biopsia
Las herramientas para obtener muestras de biopsia incluyen laparoscopia, endoscopia (superior o inferior) e intervenciones guiadas por radiografía.
Biopsia peritoneal laparoscópica
Es útil para visualizar el peritoneo y el lugar de toma de la muestra de biopsia peritoneall7,19-25. En una revisión sistemática que incluyó 402 pacientes, la sensibilidad y especificidad del examen laparoscópico diagnóstico de Tb peritoneal fue de 93 y 98%, respectivamente10. En otro estudio, que incluyó a 38 pacientes con Tb peritoneal, la biopsia laparoscópica permitió el diagnóstico histológico en 82% de los casos. El diagnóstico visual fue preciso en 95% de los casos20.
Los hallazgos laparoscópicos en la peritonitis tuberculosa incluyen20,23:
Otros hallazgos son: ganglios linfáticos agrandados, cadenas fibrinosas de “cuerdas de violín” y engrosamiento de la cara.
Las biopsias peritoneales ciegas tienen una tasa de éxito baja y se asocian con complicaciones e incluso el fallecimiento26,27.
Tratamiento
La fiebre generalmente se resuelve dentro de una semana de haber iniciado la terapia antituberculosa. Los pacientes con ascitis tienen mejoría a las pocas semanas de iniciar el tratamiento en el 90% de los casos28. Los pacientes con enteritis tuberculosa muestran, en general, una mejoría clínica en 2 semanas con el tratamiento empírico29,30. En un estudio, el seguimiento colonoscópico después de 2 a 3 meses de terapia antituberculosa mostró una curación completa de las úlceras activas y de las erosiones31.
Sin embargo, la terapia antituberculosa también puede empeorar las estenosis debido a la formación de tejido cicatricial. En los pacientes que desarrollan obstrucción, se puede justificar una intervención quirúrgica. En una serie que incluyó 106 pacientes con Tb intestinal estenosante, la estenosis se resolvió después del tratamiento antituberculoso en sólo el 25% de los pacientes32. La estenosis se resolvió con mayor frecuencia en la región ileal distal e ileocecal, seguida del intestino delgado proximal y del colon (36%, 20% y 5%, respectivamente).
Los pacientes con Tb abdominal deben ser tratados con terapia antituberculosa. Además, la cirugía está justificada en los pacientes que presentan complicaciones; v.gr.: perforación, absceso, fístula, sangrado u obstrucción de alto grado. En general, el enfoque de la terapia antituberculosa en la Tb abdominal es el mismo de la Tb pulmonar. La terapia antituberculosa puede empeorar las estenosis debido a la formación de tejido cicatrizal. En los pacientes que desarrollan obstrucción puede justificarse la intervención quirúrgica.
Pronóstico
La mortalidad varía de 8 a 50% en varias series. La edad avanzada, el retraso en el inicio del tratamiento y la cirrosis subyacente se han asociado con tasas más altas de mortalidad33,3,34.
Caso clínico
Paciente de sexo masculino, 55 años de edad, nacido de Zaruma (provincia de El Oro), residente en Quito, ocupación supervisor minero, instrucción bachiller, casado, diestro.
Revisión del estado actual de sistemas: dolor abdominal en el hipocondrio derecho.
Examen físico
FC: 97 x min. T: 38,5 °C. FR: 20 x min. TA: 115/70 mmHg. SO2: 25%.
Evolución
El paciente ingresa con síndrome febril inespecífico acompañado de dolor abdominal localizado en el hipocondrio derecho, maniobra de Murphy (-), pérdida de peso, diaforesis y astenia. Durante su hospitalización persiste el síndrome febril (38 a 38,5 °C) de predominio horario (12h00 a 14h00) a pesar de la doble terapia antipirética (paracetamol y metamizol); está acompañado de diaforesis, escalofríos y pérdida de peso.
Examen físico: se constata ascitis por lo cual se realiza paracentesis diagnóstica resultando un gradiente albúmina suero / albúmina en el líquido ascítico GASA < 1,1 g/dl con aumento de las células mononucleares (90%), leucocitos: 800 / mm3; ADA 28 u/l.
Opciones diagnósticas que se investigaron:
El paciente persiste con el síndrome febril al cual se añade un derrame pleural bilateral de pequeña cuantía y dificultad respiratoria leve que requiere suplemento de oxígeno por tenedor nasal a 1 l/min.
El día 38 de hospitalización se realiza tomografía abdominal de control que evidencia ganglios lumbares retroperitoneales de menos de 2 cm, engrosamiento del omento mayor y del peritoneo.
Se interconsulta al servicio de cirugía general que toma de una biopsia peritoneal cuya realización fue exitosa. Hallazgos: peritoneo engrosado con lesiones de color blancoamarillento con o sin adherencias, patrón fibroadhesivo, ganglios linfáticos agrandados, cadenas fibrinosas en “cuerdas de violín”; resultado histopatológico: formaciones granulomatosas con zona central de necrosis caseosa rodeadas por células gigantes tipo Langhans, células epitelioides y linfocitos; se diagnostica un proceso inflamatorio crónico granulomatoso compatible con tuberculosis peritoneal y se toma una muestra para cultivo e inicia el tratamiento antifímico con el cual el paciente mejora; no hubo reacciones adversas a la terapia, por lo cual se da el alta médica con seguimiento y administración del tratamiento en el área de salud a la cual pertenece; además, controles mensuales por consulta externa hospitalaria.
Exámenes de laboratorio
21/08/2018
Biometría hemática: leucocitos: 3.650 k/ul, neutrófilos: 2.400 k/ul, linfocitos: 700 k/ul. Hemoglobina: 12,0 g/dl.
PCR: 13,323 mg/dl, LDH: 371 u/l, albúmina: 3,3g/dl, FAL: 51 u/l, bilirrubina total: 0,77 mg/dl, globulinas: 3,28 u/l, TGO: 39, TGP: 33, BUN: 10, creatinina: 0,69 mg/dl.
Hemocultivos (24, 48 y 72 horas): negativos.
Hematozoario: negativo.
Coproparasitario: negativo. Coprocultivo: flora coliforme normal, negativo para salmonella o shigella.
Hepatitis HBs Ag < 0,10; hepatitis C < 0,02; hepatitis a IgM: 0,13; citomegalovirus IgG: 55; citomegalovirus IgM: 0,04; rubéola IgG: 99,9; rubéola IgM: 0,48; VIH: negativo; VDRL: negativo.
Anticuerpos toxoplasma IgG: > 700 positivo; anticuerpos toxoplasma IgM: 0,32 negativo.
07/09/2018
Biometría hemática: leucocitos: 5.390 k/ul; neutrófilos: 4.300 k/ul. linfocitos: 510 k/ul.
Hemoglobina: 12,7g/dl.
PCR: 33.872 mg/dl, LDH: 478 u/l, albúmina: 3,5 g/dl, FAL: 63 u/l, globulinas: 3,43 u/l, TGO: 43, TGP: 35, BUN: 12, creatinina: 0,62 mg/dl.
Exámenes de gabinete
Ecografía de abdomen superior: hígado disminuido de tamaño y de aspecto micronodular; vías biliares intrahepáticas no dilatadas; vesícula biliar distendida, paredes finas, no litos en su interior; páncreas sin alteraciones; líquido libre en la cavidad (de predominio derecho) y pelvis.
Conclusiones ecográficas: ascitis; hallazgos sugestivos de hepatopatía crónica cirrótica.
Estudio del líquido ascítico: gradiente albúmina suero / albúmina en el líquido ascítico: albúmina suero: 3,6 g/dl; albúmina líquido ascítico: 2,87 g/dl. GASA < 1,1 g/dl. Celularidad: polimorfonucleares 10%, mononucleares 90%; leucocitos: 800/mm3. Cultivo del líquido ascítico: no hay crecimiento bacteriano a las 24 y 48 h de incubación. Cuantiferon Gold Tb líquido ascítico y en sangre: 0,11 ul/ml negativo. Adenosina desaminasa del líquido ascítico (ADA): 28 u/l.
Estudios hematológicos
Frotis de sangre periférica: neutrófilos: 61; linfocitos: 31; monocitos: 8. Reticulocitos no corregidos: 1,34; corregidos: 0,73 (anemia arregenerativa).
Frotis de médula ósea: 2% de blastos de estirpe mieloide, grandes, cromatina laxa, 1 nucleolo, escasos gránulos citoplasmáticos, neutrófilos hipogranulares, hiposegmentados, eritroblastos con núcleos fragmentados.
Inmunofenotipo por citometría de flujo
Médula ósea con marcada hipocelularidad y cambios disgranulopoyéticos. No hay poblaciones de fenotipo anormal ni inmaduro.
Marcadores tumorales e inflamatorios
Alfafetoproteínas: 0 UI/ml. Antígeno carcinoembrionario (CEA): 0,9 ng/ml. Ca 125: 242,60 ul/ml; Ca 19-9: < 1,2 ul/ml. Ferritina: 1047.20 K/ul. Factor reumatideo: 7,6 UL/ml. PSA total: 0,72 ng/l. VSG: 9 UI/ml.
Endoscopias
Digestiva alta: pangastropatía eritematosa de moderada intensidad, reflujo duodenogástrico leve, duodenitis eritemato-erosiva. Colonoscopia: normal
Doppler portal
Esteatosis hepática; esplenomegalia; ascitis; hallazgos sugestivos de hepatopatía.
Ecocardiograma
Función sisto-diastólica conservada; no dilatación de cavidades; Fevi: 69%; estudio normal.
Estudios por imagen
Rx AP de tórax:
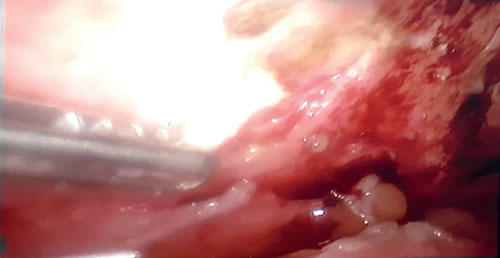
Figura 1. Derrame pleural bilateral de moderada cuantía y predominio derecho, infiltrado intersticial basal derecho.
Fuente: Los autores
Figura 2.
Fuente: Los autores
TAC de abdomen simple y contrastada (Figura 3):
Líquido libre en la cavidad peritoneal que ocupa la región abdómino-pélvica. Hígado y bazo grandes, conservan su densidad. Ganglios linfáticos lumbares: 1,1 x 1,5cm; 0,6 x 1,2 cm; 0,5 x 1 cm; 0,7 x 0,9 cm. Engrosamiento de la pared abdominal.
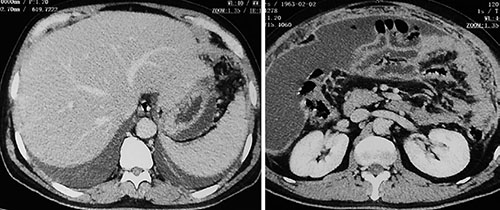
Figura 3.
Fuente: Los autores
TAC de pelvis:
Líquido libre en la cavidad; no se evidencian otros cambios patológicos (Figura 4).
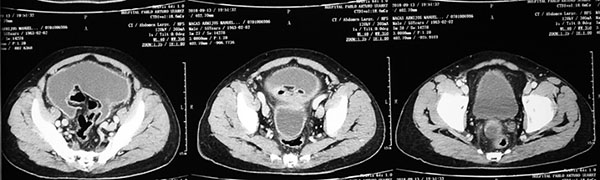
Figura 4.
Fuente: Los autores
Marcadores autoinmunitarios
ANA, ANCA C-P, C3, C4, ANTI SM, ANTI RO, ANTI LA, ANTI LC1: negativos
Biopsia laparoscópica (Figuras 5, 6 y 7)
Peritoneo engrosado con lesiones de color blanco amarillento, con múltiples adherencias, patrón fibro-adhesivo, líquido libre en la cavidad peritoneal. S toma muestra de tejido granulomatoso adherido al peritoneo parietal.
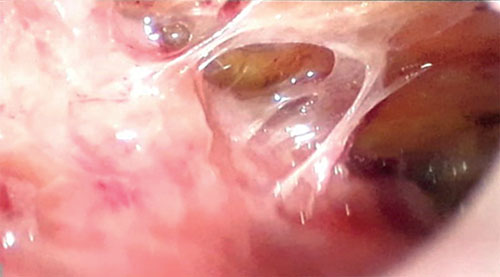
Figura 5.
Fuente: Los autores
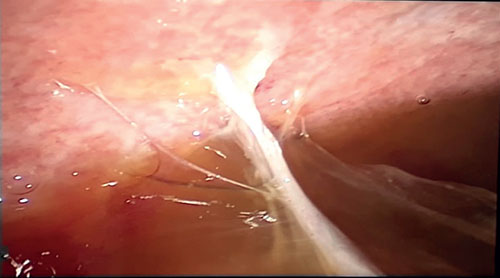
Figura 6.
Fuente: Los autores

Figura 7.
Fuente: Los autores
Estudio histopatológico
Microscopía: formaciones granulomatosas con zona central de necrosis caseosa rodeadas por células gigantes tipo Langhans, células epiteloides y linfocitos.
Diagnóstico: inflamación crónica granulomatosa sugestiva de etiología tuberculosa.
Diagnóstico de egreso
DISCUSIÓN
La tuberculosis peritoneal es una forma poco frecuente de afectación extrapulmonar de enfermedad tuberculosa. Su aparición se debe, en la mayoría de los casos, a la reactivación de los focos peritoneales procedentes del pulmón que llegan por la vía hematógena.El riesgo de infección aumenta en las siguientes condiciones de riesgo: inmunosupresión, tratamiento con corticoides, cirrosis hepática, diabetes mellitus, neoplasias, diálisis peritoneal, entre otros35.
El 70% de los pacientes presentan síntomas de varios meses de evolución previos al diagnóstico; los más frecuentes son: dolor abdominal por ascitis (90% de los casos), fiebre y pérdida de peso. Una minoría presenta una fase avanzada denominada “peritonitis seca”36.
Los hallazgos significativos de laboratorio son: aumento del Ca 125 (que es marcador de actividad de la enfermedad). Una vez iniciado el tratamiento, comienza a descender en aproximadamente 8 semanas: la sensibilidad de los tests serológicos suele ser de 60 a 80% y usualmente ayuda en los casos de enfermedad avanzada37.
La cuantificación de la ADA (adenosina-desaminasa) -enzima del metabolismo de las purinas presente durante la maduración de los monocitos, macrófagos y linfocitos T- generalmente es alta. Su sensibilidad y especificidad en el test serológico de ADA en la ascitis tuberculosa son de 100 y 97%, respectivamente, cuando el valor es superior de 33 u/l37.
De los estudios por imágenes, la ecografía y la tomografía pueden evidenciar ascitis, septos y adherencias intraperitoneales que sugieren tuberculosis peritoneal, y contribuyen a indicar la realización de laparoscopia y toma de biopsia, que precisan el diagnóstico. La gammagrafía con galio 67 también es útil en el diagnóstico diferencial de la tuberculosis peritoneal y de las enfermedades neoplásicas; v.gr.: linfoma, carcinosis peritoneal, carcinoma ovárico, mesotelioma.
La mortalidad causada por la laparotomía es de 3 a 12%, mientras que la morbimortalidad de esta técnica oscila entre 0,04 y 0,5% en estudios antiguos; actualmente, se reporta una mortalidad de 5% en algunos estudios38,39.
El diagnóstico se establece mediante los siguientes hallazgos40:
Todo lo expuesto contrasta con lo encontrado en nuestro caso, en el cual se precisó, mediante laparoscopia, que fue el último recurso diagnóstico frente a un síndrome febril prolongado asociado con dolor abdominal, ascitis y pérdida de peso; pues las pruebas serológicas de alta sensibilidad y especificidad (incluyendo el Cuantiferon TB Gold -IGRA-), fueron negativas; estos resultados contrastan con los encontrados en el estudio publicado por el Departamento de Cirugía, Facultad de Medicina de la Universidad de Corea, Hospital de Guro de la Universidad de Corea, 80, Gurodong, Guro-gu, Seúl, República de Corea. drhkd@korea.ac.kr, que estudió retrospectivamente a 60 pacientes mediante laparoscopia, por sospecha de Tb peritoneal, entre enero de 2002 y junio de 2010. La precisión y valor predictivo de la observación mediante la laparoscopia fue la prueba importante.
En las pruebas no invasivas, tanto el nivel de adenosina-desaminasa ascítica (ADA) mayor de 30 U/l como el de lactato-deshidrogenasa ascítica (LDH) mayor de 90 U/l fueron positivos, y negativos relativamente altos.
Las tasas generales de morbilidad y mortalidad por laparoscopia fueron de 5 y 5%, respectivamente; por lo cual se concluyó que la laparoscopia es un recurso diagnóstico rápido y preciso de Tb peritoneal. No obstante, pueden ocurrir complicaciones. En los pacientes de edad avanzada que padecen de afecciones asociadas se necesita una combinación de varias pruebas no invasivas y tratamientos empíricos previos a la laparoscopia41.
Un segundo estudio retrospectivo del Hôpital de Tenon, Service de Chirurgie Digestive, 4, rue de la Chine, 75020 París, Francia (Service de Chirurgie Générale, hibital Habib Bourguiba, 3029 Sfax, Tunisie, Servicio de quirúrgica digestiva, local Habib Bourguiba, 3029 Sfax, Tunisie), se analizaron 60 casos de tuberculosis peritoneal recogidos entre enero de 2004 y diciembre de 2009. La mediana de edad fue de 41 años y la proporción de sexos de 0,4. Los motivos de consulta dominantes fueron el dolor y la distensión abdominales. La ecografía abdominal encontró ascitis en todos los pacientes. La tomografía computarizada (TC) se realizó en 30 pacientes y confirmó los datos del ultrasonido. La paracentesis de la ascitis se realizó en todos los pacientes, recogiendo líquido exudativo en todos; hubo predominio de linfocitos en el 83%. La detección de Mycobacterium tuberculosis en el examen directo del líquido ascítico y en el cultivo, fue positivo en 43 casos y negativo en los demás. La biopsia quirúrgica se realizó por laparoscopia en 29 pacientes y por laparotomía en 31 pacientes. El examen histológico de las biopsias peritoneales confirmó el diagnóstico de tuberculosis peritoneal en todos los casos42.
CONCLUSIONES
Se presentó un caso de tuberculosis peritoneal de la cual se tuvo alta sospecha clínica debido a los factores de riego de exposición familiar, síntomas y signos constitucionales e infeccioso, ausencia de enfermedad hepática preexistente que justificara la ascitis, además de un síndrome febril prolongado de etiología no precisada, por lo cual se realizaron los exámenes generales y específicos correspondientes que evidenciaron la negatividad del diagnóstico en la mayoría de ellos, como la prueba IGRA (interferon-gamma release assay: ensayo de liberación de interferón-gamma) que fue diseñada para complementar el diagnóstico de infección tuberculosa latente e incrementar la sensibilidad y especificidad, al cuantificar el interferón-gamma producido por los linfocitos-T sensibilizados en respuesta al contacto con antígenos específicos de Mycobacterium tuberculosis, aunque dicha prueba es incapaz de discriminar una infección previa o actual por este Mycobacterium; tampoco puede diferenciar entre infección tuberculosa latente y activa. Existen 2 pruebas IGRA disponibles: QuantiFERON®-TB Gold In-Tube y T-SPOT® TB.
La utilidad es mayor en pacientes inmunocompetentes mayores de 5 años de edad; no obstante, la eficacia clínica resulta afectada en los pacientes inmunodeprimidos como nuestro paciente (hipoplasia medular, diabetes mellitus tipo 2), debido a la síntesis reducida y fluctuante de interferón-gamma en dicho grupo de pacientes. Varios factores, como la inmunosupresión, contribuyen a obtener resultados indeterminados (lo cual debe considerarse al momento de interpretar la prueba) debiendo realizar biopsia como último recurso para establecer el diagnóstico definitivo y el tratamiento oportuno. Se procedió a realizar una revisión bibliográfica que permitió encontrar estudios de serie de casos en los cuales el último recurso fue la biopsia laparoscópica debido a la negatividad de los estudios serológicos de Tb peritoneal y a la alta sospecha clínica.
CONTRIBUCIÓN DE LOS AUTORES
Yuan Leonel Kuonqui Vera: Concepción y diseño del trabajo; recolección y obtención de resultados; análisis e interpretación de datos; redacción del manuscrito.
Conflicto de interés
Los autores declararon no tener ningún conflicto de interés personal, financiero, intelectual, económico y de interés corporativo con el Hospital Metropolitano y los miembros de la revista MetroCiencia.
REFERENCIAS BIBLIOGRÁFICAS
Kuonqui Vera YL, Molestina MJ, Calvo González MA, Pauker Álvarez AE. Tuberculosis peritoneal. Caso clínico diagnosticado por laparoscopia. MetroCiencia. 2020 ene; 28(1): p. 48-57. DOI: https://doi.org/10.47464/MetroCiencia/vol28/1/2020/48-57. Available from: https://revistametrociencia.com.ec/index.php/revista/article/view/57