

Editorial: Hospital Metropolitano
ISSN (impreso) 1390-2989 - ISSN (electrónico)2737-6303
Edición: Vol. 29 Nº 2 (2021) Abril - Junio
DOI: https://doi.org/10.47464/MetroCiencia/vol29/2/2021/23-31
URL: https://revistametrociencia.com.ec/index.php/revista/article/view/171
Pág: 23-31
Camilo Zurita-Salinas1,2 , Francisco Xavier Mora3
, Francisco Xavier Mora3 , Hugo Ricardo Espejo3
, Hugo Ricardo Espejo3 ,
,
Marco Antonio Bonifaz3 , Gabriela Sevillano1
, Gabriela Sevillano1 , Pablo González-Andrade1
, Pablo González-Andrade1 ,
,
Cristina Aguilera1 , Johanna Escobar1
, Johanna Escobar1 , Jeannete Zurita1,4
, Jeannete Zurita1,4
Unidad de Investigaciones en Biomedicina. Zurita & Zurita Laboratorios. Quito, Ecuador1
Cátedra de Inmunología. Universidad Central del Ecuador. Quito, Ecuador2
Hospital IESS Quito Sur. Quito, Ecuador3
Facultad de Medicina. Pontificia Universidad Católica del Ecuador. Quito, Ecuador 4
Para muchos individuos sintomáticos, un solo resultado negativo de qRT-PCR (una de las varias pruebas NAAT) es suficiente para excluir el diagnóstico de COVID-19, sin embargo, si la prueba inicial es negativa pero la sospecha de COVID-19 sigue siendo alta y la confirmación de la presencia de infección es importante para el manejo o control de la infección, es imprescindible repetir la prueba. Un resultado negativo no excluye la posibilidad de una infección por SARS-CoV-2 y no debe utilizarse como el único criterio para tratamiento o decisiones de manejo del paciente. La combinación de qRT-PCR junto con una tomografía y las características clínicas-epidemiológicas facilitan el manejo de los pacientes con SARS-CoV-2. Este artículo tiene como objetivo analizar pacientes atendidos por COVID-19 en un hospital del sur de Quito, al inicio de la pandemia, que presentaron una prueba de qRT-PCR negativa. A los pacientes se les realizó detección de anticuerpos, estos fueron positivos debido a que las muestras de sangre fueron tomadas después de 2 semanas del inicio de los síntomas.
Palabras claves: qRT-PCR, Anticuerpos, SARS-CoV-2, COVID-19, ELISA.
For many symptomatic individuals, a single negative qRT-PCR, (one of the several Nucleic Acid Ampiflication Tests: NAATs) is sufficient to exclude the diagnosis of COVID-19, however, if the initial test is negative but the suspicion of COVID-19 remains high and confirmation of the presence of infection is important for the management or control of the infection, is recommended to repeat the test. A negative result does not exclude the possibility of a SARS-CoV-2 infection and should not be used as the sole criterion for treatment or patient management decisions. The combination of qRT-PCR together with a tomography and the clinical-epidemiological characteristics facilitates the management of patients with SARS-CoV-2. This article aims to analyze patients treated of COVID-19 treated in a general hospital in the south of Quito, at the beginning of the pandemic, which presented a negative qRT-PCR test. Antibody detection was performed. These were positive because blood samples were taken about 2 weeks from the onset of symptoms.
Keywords: qRT-PCR, Antibodies, SARS-CoV-2, COVID-19, ELISA.
| Camilo Zurita-Salinas: | https://orcid.org/0000-0002-2656-773X |
| Francisco Xavier Mora: | https://orcid.org/0000-0003-3562-5302 |
| Hugo Ricardo Espejo: | https://orcid.org/0000-0002-9336-5097 |
| Marco Antonio Bonifaz: | https://orcid.org/0000-0002-2248-2819 |
| Gabriela Sevillano: | https://orcid.org/0000-0002-1133-5960 |
| Pablo González-Andrade: | https://orcid.org/0000-0003-3885-3116 |
| Cristina Aguilera: | https://orcid.org/0000-0001-6687-485X |
| Johanna Escobar: | https://orcid.org/0000-0002-1362-917X |
| Jeannete Zurita: | https://orcid.org/0000-0002-9935-2588 |
| Correspondencia: | Dra. Jeannete Zurita |
| Teléfonos: | 593 999455607 |
| e-mail: | jzurita@zuritalaboratorios.com |
INTRODUCCIÓN
La enfermedad por el coronavirus SARS-CoV-2 (COVID-19) se detectó por primera vez en China en diciembre de 2019 y la Organización Mundial de la Salud (OMS) la declaró como pandemia el 11 de marzo de 20201,2. El tratamiento actual de COVID-19 se basa generalmente en la terapia de apoyo y tratamiento para prevenir la insuficiencia respiratoria. La rápida secuenciación del genoma del virus SARS-CoV-23, ha permitido el desarrollo de los ensayos de reacción en cadena de la polimerasa (qRT-PCR) que se han convertido en el estándar de oro para detectar ARN viral e identificar a pacientes enfermos con COVID-19 así como asintomáticos. Sin embargo, algunos pacientes con hallazgos radiológicos de tórax positivos y síntomas sospechosos de COVID-19 han dado resultados negativos en la qRT-PCR del SARS-CoV-2 y requieren múltiples pruebas consecutivas para convertir a un resultado positivo4,5. Al inicio de la pandemia la información era limitada sobre las características de rendimiento clínico de las pruebas moleculares del SARS-CoV-2 en el entorno clínico, en particular cuál era el valor predictivo y cuál la relación entre el curso de la enfermedad, la diseminación viral, y positividad de los distintos ensayos moleculares. Hemos identificado seis casos hospitalizados graves de COVID-19 con qRT-PCR negativos al momento del ingreso al Hospital General Quito Sur, del Instituto Ecuatoriano de Seguridad Social (HQSur) atendidos al inicio de la pandemia durante el mes de marzo de 2020.
MATERIALES Y MÉTODOS
Identificación de los pacientes: análisis retrospectivo de pacientes hospitalizados en marzo de 2020. Aquellos pacientes con sintomatología de COVID-19 y cuyo qRT-PCR fue negativo, según el historial clínico fueron ingresados en el estudio.
Detección del virus mediante prueba qRT-PCR: El test diagnóstico in vitro de Roche que se utilizó al inicio de la pandemia en el Ecuador durante el mes de marzo 2020 para la detección cualitativa del ARN viral sigue un algoritmo establecido de dos detecciones por PCR en tiempo real, primero la detección del gen E, seguido de una detección de confirmación con la secuencia RdRP que se encuentra en el marco abierto de lectura 1ab (ORF1ab) del genoma SARS-CoV-2. El ARN del virus que se extrae de la muestra se purifica y se mezcla con la enzima llamada transcriptasa inversa, que convierte el ARN de una sola cadena en ADNc de doble cadena, el mismo que a continuación es sometido al proceso de amplificación por PCR en tiempo real. Ambas pruebas de valoración incluyen un sistema de amplificación heterólogo (control interno) para identificar una posible inhibición de RT-PCR y para confirmar la integridad de los reactivos del kit. En ambos ensayos, las sondas específicas para ARN de SARS-CoV-2 están marcadas con el fluorocromo FAMTM. La sonda específica para el control interno está marcada con el fluorocromo JOETM. El uso de sondas unidas a diferentes fluorocromos ARN específico del virus de SARS-CoV-2 y el control interno de los canales detectores correspondientes del instrumento de PCR en tiempo real6. Esta metodología detecta hasta 10 copias ARN/reacción7. Al hacer pruebas paralelas de muestras con el gen E y con el gen RdRP, pueden cumplirse los requisitos de la OMS para la confirmación de caso de SARS-CoV-2 de laboratorio. De este modo, a todos los pacientes se realizó un screening o tamizaje con el gen E y luego un confirmatorio con RdRP. Si el gen E no fue detectado (negativo) se informó como tal y si el gen E fue detectado se procedió a la realización de una segunda detección para la búsqueda del gen confirmatorio RdRP. El proceso completo tardó alrededor de cuatro horas. Los resultados fueron reportados como DETECTADO, en caso de ser positivas las dos detecciones, y como NO DETECTADO en el caso contrario.
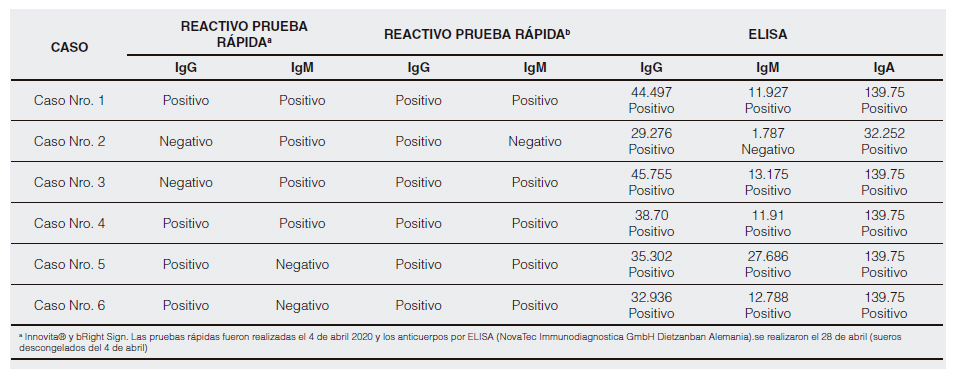
Detección de anticuerpos: A los pacientes se les realizó una prueba inmunocromatográfica (flujo lateral, oro coloidal) de dos diferentes marcas comerciales. Inicialmente se realizó flujo lateral, pues eran las únicas pruebas con las que se contaban en ese momento en el país. Los sueros fueron congelados y, al momento que llegaron las pruebas de ELISA al Ecuador, se procedió a realizar los ensayos IgG, IgM e IgA usando la prueba de ELISA (Enzyme-Linked ImmunoSorbent Assay) (NovaTec Immunodiagnostica GmbH Dietzanban Alemania) en estos sueros.
RESULTADOS
De la población estudiada, un total de seis pacientes cumplieron con los criterios de tener sintomatología consistente con COVID-19 y con qRT-PCR negativa en el periodo comprendido entre el 22 y el 29 de marzo del 2020. Los pacientes fueron clasificados como “casos graves” aquellos que tenían cualquiera de las siguientes características en el momento de la admisión: frecuencia respiratoria (≥20 respiraciones por minuto); saturación de oxígeno en reposo ≤90% o <92% con taquipnea; tensión arterial sistólica <90 mmHg; relación entre la presión parcial de oxígeno arterial y la concentración parcial de oxígeno en aire inspirado ≤200 mmHg; o complicaciones graves de la enfermedad (p. ej., insuficiencia respiratoria, necesidad de ventilación mecánica, shock séptico o insuficiencia orgánica no respiratoria). Todas las muestras nasofaríngeas fueron recolectadas de acuerdo con las pautas de la OMS8.
Los pacientes fueron manejados de acuerdo con el protocolo descrito por el HQSur “Protocolo para el manejo de paciente COVID-19 (Quick Guide COVID-19)”. En todos los casos se realizó tomografía computarizada (TC) de tórax, que permite analizar imágenes tridimensionales y a través de un software se puede conocer el porcentaje de probabilidad de que el paciente esté cursando una neumonía causada por SARS-CoV-2. Este software tecnológico contiene miles de imágenes almacenadas, a escala mundial, de lesiones sospechosas de los pulmones de pacientes afectados por el COVID-19, lo que permite comparar los resultados que se obtengan en los hospitales del Ecuador, y así contar con un diagnóstico más certero y rápido (http://spanish.xinhuanet.com/2020-03/23/c_138905641.htm). Este sistema fue donado por la empresa Huawei al hospital HQSur el mismo que se define como “Sistema de detección de COVID-19 con TC y AI.”
Características clínicas
Este informe incluye 6 pacientes hospitalizados con sospecha de COVID-19. Los casos han sido detallados en la Figura 1. La información clínica se resume en la Tabla 1. Los estudios serológicos se presentan en la Tabla 2.
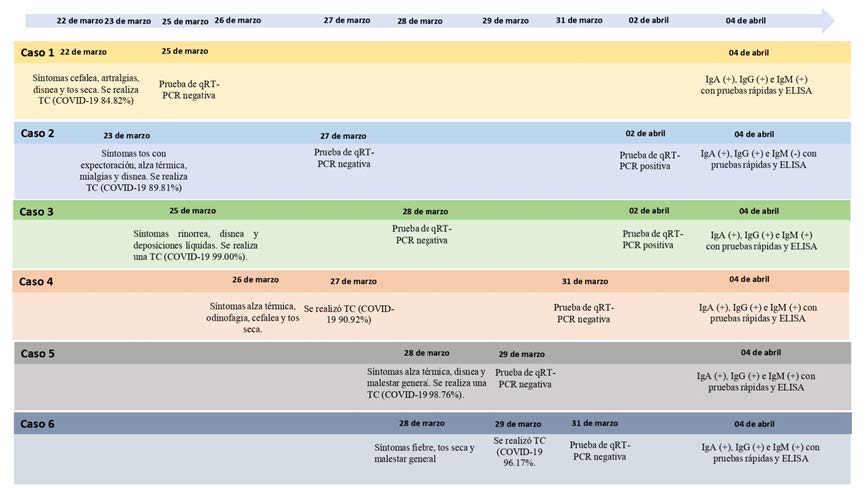
Figura 1. Cronología de los casos. Se muestran los síntomas y las pruebas de diagnóstico.
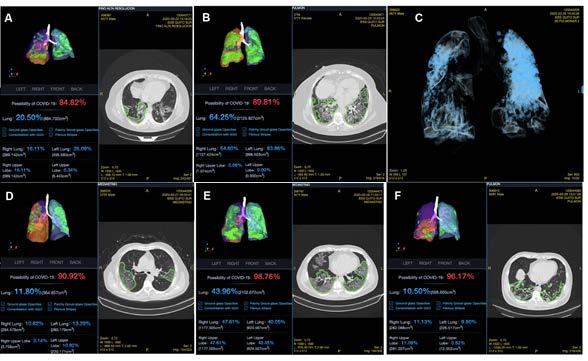
Figura 2. Tomografía computarizada de pacientes. A) Caso 1. Infiltrado bilateral periférico, tendencia a la consolidación con broncograma aéreo en bases pulmonares, cuya probabilidad de padecer COVID-19 basado en la comparación con inteligencia artificial es del 84,82%; se describe un 20,50% de afectación pulmonar total. B) Caso 2. Parches bilaterales periféricos que cubren un área de 2/3 de la superficie pulmonar de predominio en bases, cuya probabilidad de padecer COVID-19 basado en la comparación con inteligencia artificial es del 89,81%; se describe un 65,25% de afectación pulmonar total. C) Caso 3. Parches bilaterales periféricos que cubren un área de 1/3 de la superficie pulmonar de predominio en bases, cuya probabilidad de padecer COVID-19 basado en la comparación con inteligencia artificial es del 99,92%; se describe un 75,63% de afectación pulmonar total. D) Caso 4. Parches bilaterales periféricos que cubren un área de 1/3 de la superficie pulmonar de predominio en bases, cuya probabilidad de padecer COVID-19 basado en la comparación con inteligencia artificial es del 90,92%; se describe un 11,80% de afectación pulmonar total. E) Caso 5. Infiltrado bilateral periférico, tendencia a la consolidación con broncograma aéreo en bases pulmonares, cuya probabilidad de padecer COVID-19 basado en la comparación con inteligencia artificial es del 96,17%; se describe un 10,50% de afectación pulmonar total. F) caso 6. Infiltrado bilateral periférico, tendencia a la consolidación con broncograma aéreo en bases pulmonares, cuya probabilidad de padecer COVID-19 basado en la comparación con inteligencia artificial es del 96,17%; se describe un 10,50% de afectación pulmonar total.
Tabla 1. Datos de los pacientes. Resultados de qRT-PCR.
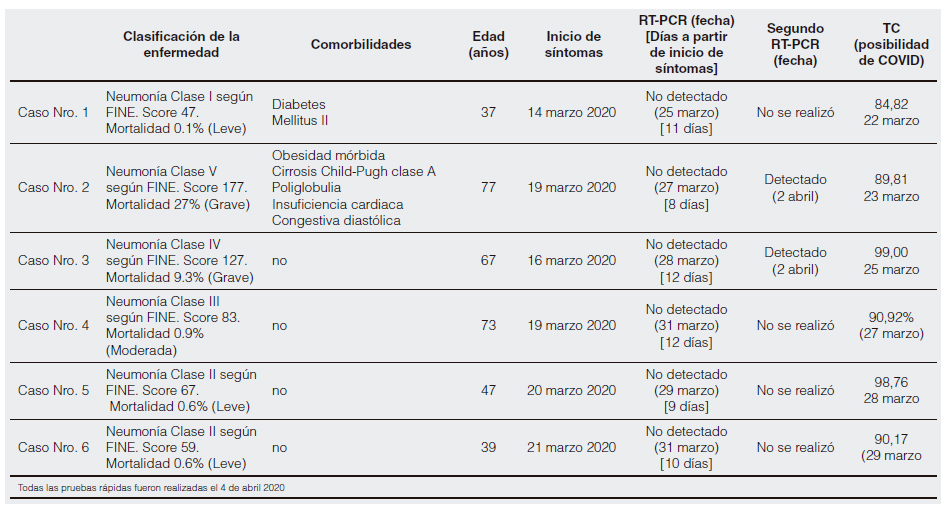
Tabla 2. Anticuerpos IgG, IgM e IgA con metodología de flujo lateral (oro coloidal) y ELISA.
DISCUSIÓN
Las pruebas basadas en la detección de los ácidos nucleicos NAAT (del inglés Nucleic Acid Amplification Tests) se han convertido en un método rápido y de tecnología confiable para la detección viral. Existen varias pruebas NAAT que pueden amplificar los ácidos nucleicos del virus y utilizar métodos diferentes para amplificar los ácidos nucleicos y detectar el virus, como, por ejemplo:
Dentro de estas pruebas LAMP están la reacción de amplificación de endonucleasa de mellado (NEAR), la amplificación dependiente de helicasa (HDA) y la de repeticiones palindrómicas cortas agrupadas regularmente interespaciadas (CRISPR). El procedimiento NAAT funciona primero amplificando, o haciendo muchas copias, del material genético del virus, si hay alguno presente en la muestra de una persona. La amplificación de esos ácidos nucleicos permite que las NAAT detecten cantidades muy pequeñas de ARN del SARS-CoV-2 en una muestra, lo que hace que estas pruebas sean muy sensibles para diagnosticar COVID-19. En otras palabras, las NAAT pueden detectar de manera confiable pequeñas cantidades de SARS-CoV-2 y es poco probable que devuelvan un resultado falso negativo de SARS-CoV-2.
Entre estas pruebas se considera el método RT-PCR como el "estándar de oro" para la detección de algunos virus y se caracteriza por una detección rápida, alta sensibilidad y especificidad. Como tal, la prueba qRT-PCR es de gran interés en la actualidad para la detección del SARS-CoV-2 por sus beneficios como ensayo cualitativo específico y sencillo9-10. Además, la qRT-PCR en tiempo real tiene una sensibilidad adecuada y nos ayuda a diagnosticar una infección temprana. Por lo tanto, se puede considerar un ensayo de qRT-PCR en tiempo real como un método de referencia y como método principal a aplicar para detectar el virus SARS-CoV-2. Sin embargo, la Sociedad de Enfermedades Infecciosas de América (IDSA) ha sugerido prioridades para las pruebas cuando la capacidad de realización de las mismas es limitada; las personas de alta prioridad incluyen pacientes hospitalizados (especialmente pacientes críticamente enfermos con enfermedades respiratorias inexplicables) e individuos sintomáticos que son trabajadores de la salud o socorristas, trabajan o residen en entornos de vida colectiva o tienen factores de riesgo de enfermedad grave11.
Un problema importante con la prueba de qRT-PCR en tiempo real es el riesgo de obtener resultados falsos negativos y falsos positivos. Los resultados falsos positivos son raros, pero se han notificado en diferentes circunstancias. Parece que la combinación de RT-PCR en tiempo real en conjunto con las características clínicas, facilita el manejo del brote de SARS-CoV-2. Se han reportado casos con clínica típica y características de COVID-19, corroboradas con imágenes de TC, pero que no se diagnosticaron con una prueba de qRT-PCR12. Así, un resultado negativo no excluye la posibilidad de una infección por SARS-CoV-2 y no debe utilizarse como el único criterio para tratamiento o decisiones de manejo del paciente. Los casos que presentamos tuvieron características de la enfermedad COVID-19 con prueba inicial de qRT-PCR negativa para el virus SARS-CoV-2. Los pacientes presentaban las características de gravedad ya descritas en el momento del ingreso o después del ingreso. Además, se observaron complicaciones graves de la enfermedad (p. ej., insuficiencia respiratoria, necesidad de ventilación mecánica, choque séptico o insuficiencia de órganos no respiratorios). Tres pacientes se clasificaron como casos leves y tres como casos graves. Un paciente murió a causa de la infección. Tres de los 6 pacientes graves recibieron tratamiento en la Unidad de Cuidados Intensivos (UCI), los casos leves fueron manejado en el servicio de Neumología.
De acuerdo con los relatos de los pacientes los síntomas iniciaron entre 7 y 8 días antes del ingreso al hospital. A pesar de que se ha informado que pacientes graves con COVID-19 tienen alta carga viral y dispersan el virus por largos períodos, de acuerdo con la observación de Lui Y. et al.15 esto no fue observado en nuestra serie de casos, en los cuales 6 pacientes graves, con un cuadro de neumonía instaurado tuvieron al ingreso un RT-PCR negativo. Los pacientes con COVID-19 grave tienden a presentar una alta carga viral y un largo período de eliminación del virus. Este hallazgo sugiere que la carga viral de SARS-CoV-2 podría ser un marcador útil para evaluar la gravedad y el pronóstico de la enfermedad.
Desde el punto de vista clínico, las manifestaciones clínicas, junto con la TC, podrían utilizarse para catalogar un caso como altamente sospechoso y para tomar las medidas necesarias, mientras que la qRT-PCR sirve como una herramienta de confirmación, cuyos resultados podrían utilizarse más tarde para decidir acciones posteriores de continuar el tratamiento en aislamiento, el alta del paciente, o la implementación de un cerco epidemiológico. En todo paciente con sintomatología y qRT-PCR que no haya detectado el virus (negativo) se debe repetir la muestra, preferiblemente ya no del tracto respiratorio superior sino un esputo, lavado broncoalveolar o aspirado traqueal. Dos de estos seis pacientes con una prueba qRT-PCR SARS-CoV-2 negativa al inicio tuvieron una segunda toma nasofaríngea para detección del virus SARS-CoV-2. La segunda toma de ambos pacientes fue reportada como detectada. En muchas ocasiones un solo resultado negativo de NAAT es suficiente para excluir el diagnóstico de COVID-19. Sin embargo, las pruebas NAAT falsas negativas (p. ej: qRT-PCR) de muestras de las vías respiratorias superiores han sido bien documentadas. Si la prueba inicial es negativa, pero persiste la sospecha de COVID-19 y la confirmación de la presencia de infección es importante para el manejo o control de la infección, sugerimos repetir la prueba. Se desconoce el momento óptimo para repetir la prueba; generalmente se realiza de 24 a 48 horas después de la prueba inicial.
La precisión y los valores predictivos de las NAAT del SARS-CoV-2 no se han evaluado sistemáticamente, aun así, se consideran pruebas muy específicas13. Aunque las NAAT tienen una alta sensibilidad analítica en entornos ideales; es decir, pueden detectar con precisión niveles bajos de ARN viral en muestras de prueba que se sabe que contienen ARN viral, el rendimiento clínico es más variable13.
Además, la sensibilidad de la qRT-PCR varía de acuerdo con el tipo de muestra: el esputo tiene una tasa positiva del 74,4-88,9%, seguida de hisopos nasales que iban del 53,6-73,3%14. El mismo autor señala que también influye el momento en que la muestra ha sido colectada. Así, si una muestra fue recogida ≥ 15 días después del inicio de los síntomas, el esputo y los hisopos nasales poseían una tasa positiva que varía del 42,9-61,1%; los hisopos de garganta recogidos ≥ 8 días después del inicio de los síntomas fue baja, especialmente en casos de pacientes con síntomas leves. Para el análisis de qRT-PCR se recolectaron en primera instancia hisopados nasofaríngeos, es decir, especímenes de vías respiratorias superiores. Y, a pesar de que se recomienda la implementación de lavados broncoalveolares y aspirados traqueales, la tipología y características ventilatorias de los pacientes graves no nos conceden las garantías de un proceso de extracción de muestras sin tener efectos adversos en la evolución de los pacientes. Además, son procedimientos que muy escasamente se llevan a cabo en pacientes graves.
La prueba de ácido nucleico o secuenciación genética para SARS-CoV-2 se considera como el método estándar de oro para la confirmación de la infección de SARS-CoV-2. Se ha sugerido que una de las razones de los resultados falsos negativos de qRT-PCR es que las muestra podrían tener una carga viral insuficiente para ser detectada o podría estar involucrado un error de laboratorio16. A partir de estos seis casos, especulamos que las rutas de infección, el estado de progresión de la enfermedad (tiempo y métodos de recolección de muestras) y la coinfección con otros virus podrían influir en la precisión de la prueba de qRT-PCR. Li et al. 2020, al monitorear los datos de su hospital del 21 al 31 de enero de 2020, observaron que 2/10 casos negativos inicialmente, luego fueron detectados por qRT-PCR, produciendo una tasa falsamente negativa de aproximadamente el 20%17. Los casos de nuestro estudio pueden ser considerados como falsos negativos, debido a que 2/6 pacientes que se repitieron la prueba fue positiva, en otros dos pacientes no se tomaron otras muestras, pero por la sintomatología y los hallazgos radiográficos, se consideraron COVID-19. En un estudio, aproximadamente el 96% de los pacientes con COVID-19 presentaron anormalidades en la TC de tórax, como opacidades y consolidación de vidrio esmerilado bilateral y periférico múltiple, lo que hace que las características de TC de tórax sean esenciales para reconocer COVID-1918. Por otro lado, la Comisión Nacional de Salud de China revisó los criterios de diagnóstico en la provincia de Hubei, donde ocurrió una epidemia severa y estableció un nuevo tipo de diagnóstico llamado "Diagnóstico clínico" de acuerdo con la presencia de neumonía en la TC de tórax, independientemente de los resultados de RT-PCR. Hasta cierto punto, las características de TC y los resultados de qRT-PCR fueron complementarios en el diagnóstico de COVID-1919.
De acuerdo con el estudio de Green D. y cols.20 la sensibilidad clínica del qRT-PCR- SARS-CoV-2 puede estimarse entre 57,9% (95% CI = 55,2 a 60,5) a 94,6% para una única prueba inicial o 69,3% (95% CI = 66,8 a 71,7) a 96,0% al considerar la repetición de la prueba. Ellos observaron que la menor sensibilidad de la prueba qRT-PCR realizada en el primer día puede aumentarse como resultado de repeticiones de la prueba. Esto puede explicarse debido a que la diseminación viral aumenta con el tiempo en un paciente recientemente infectado y finalmente cruzan el umbral de detección en muestras posteriores. Puede suceder también que si se recolecta incorrectamente un número significativo de muestras y se repiten las pruebas aumenta la probabilidad de detección; esto es particularmente probable en el primer día, cuando la sospecha puede ser alta pero los resultados iniciales de la prueba fueron negativos o inconclusos. O una tercera posibilidad, es que los pacientes evaluados inicialmente fueron verdaderamente negativos y adquirieron la infección nosocomialmente después del ingreso.
La sensibilidad de la prueba puede variar según el tipo de muestra. Las muestras de las vías respiratorias inferiores pueden tener cargas virales más altas y es más probable que den resultados positivos en las pruebas que las muestras de las vías respiratorias superiores21,22. En un estudio de 205 pacientes con COVID-19 que fueron muestreados en varios sitios, las tasas más altas de pruebas positivas de ARN viral se reportaron en el lavado broncoalveolar (95%, 14 de 15 muestras) y esputo (72%, 72 de 104 muestras), en comparación con el hisopado orofaríngeo (32%, 126 de 398 muestras)21. La probabilidad de detectar ARN SARS-CoV-2 también puede variar según la duración de la enfermedad. Las tasas estimadas de resultados falsos negativos fueron del 100% el día de la exposición, del 38% el día 5 (estimado como el primer día de síntomas), el 20% el día 8 y el 66% el día 2123. La heterogeneidad entre los estudios y las suposiciones hechas en el análisis, como, por ejemplo, el período de incubación y el tiempo de exposición, reducen la confianza en estos resultados. Guo et al.24 utilizaron una combinación de qRT-PCR y una prueba serológica de IgM para hacer el diagnóstico de COVID-19 y sugirió que las tasas de qRT-PCR negativas eran <10 % en los días 1 a 3 de la enfermedad, > 20% en el día 6 y > 50% después del día 14; sin embargo, estos resultados también deben interpretarse con precaución, ya que la prueba serológica utilizada no fue validada para la detección de infección aguda y las pruebas de IgM suelen dar falsos positivos. Otros estudios también han sugerido que los niveles de ARN viral son altos antes del desarrollo de los síntomas (es decir, en pacientes pre-sintomáticos)25.
Las plataformas de diagnóstico utilizadas para la detección de anticuerpos específicos contra las proteínas del SARS-CoV-2 incluyen pruebas de diagnóstico, tales como ensayos de flujo lateral, ensayos inmunoabsorbentes ligados a enzimas, ensayos de neutralización e inmunoensayos quimioluminiscentes26. Este se basa en la detección de anticuerpos IgM y IgG producidos contra la nucleocápside del SARS-CoV-2. De las varias proteínas que contiene la nucleocápside, la nucleoproteína N es la más abundante durante la infección, y el antígeno más reactivo y adicionalmente la nucleoproteína N está extremadamente conservada entre humanos infectados por los β-coronavirus29,30. Sin embargo, la confiabilidad del resultado de la prueba serológica depende del análisis específico y la duración de la enfermedad. Aunque el uso principal de las pruebas serológicas es determinar la exposición previa al SARS-CoV-2, la detección de anticuerpos específicos puede respaldar el diagnóstico de COVID-19 en un paciente con una alta sospecha clínica, pero pruebas de PCR negativas27. Como se ha podido observar en estos seis casos.
A pesar de las ventajas de utilizar la técnica ELISA, según los CDC-USA, las pruebas serológicas no deben utilizarse para diagnosticar la fase aguda de la enfermedad (dentro de los 7 días desde el inicio de los síntomas); sin embargo, en nuestro estudio se demuestra que los anticuerpos fueron de ayuda diagnóstica. El método serológico está recomendado para detectar una posible infección previa en la fase de convalecencia, considerando el período de 14 días después del inicio de los síntomas; para la evaluación retrospectiva de brotes, estudios epidemiológicos, cribado, diagnóstico de pacientes asintomáticos y contactos cercanos de casos confirmados.
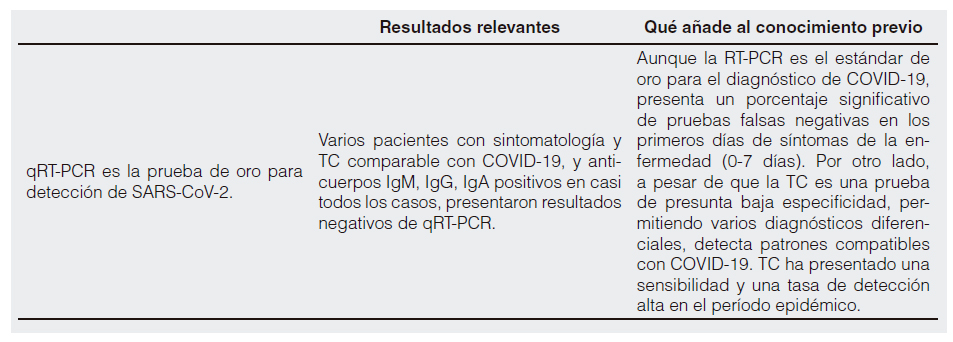
Aunque la RT-PCR es el estándar de oro para el diagnóstico de COVID-19, presenta un porcentaje significativo de pruebas falsas negativas en los primeros días de síntomas de la enfermedad (0-7 días). Por otro lado, a pesar de que la TC es una prueba de presunta baja especificidad28, a permitido varios diagnósticos diferenciales28, detecta patrones compatibles con COVID-19. Ha presentado una sensibilidad muy alta y un valor predictivo positivo significativo y una tasa de detección en el período epidémico28,29.
En conclusión, en pacientes hospitalizados con sospecha de COVID-19 que tienen una qRT-PCR de SARS-CoV-2 negativa, los hallazgos característicos de laboratorio o de imágenes pueden respaldar aún más el diagnóstico clínico de COVID-19 y ser razones para mantener las precauciones de control de infecciones. La alta sensibilidad y tasa de detección de la TC demuestran que tiene un alto grado de importancia en las primeras etapas de la enfermedad, incluso mayor que la qRT-PCR. De la misma manera la detección de anticuerpos específicos puede respaldar el diagnóstico de COVID-19 en un paciente con una alta sospecha clínica, pero pruebas de PCR negativas. Es importante considerar otras causas potenciales de síntomas en pacientes con qRT-PCR negativas para SARS-CoV-2. Para los pacientes que se presentan de tres a cuatro semanas en el curso de la enfermedad y tienen una qRT-PCR negativa, comprobar con una prueba serológica puede ser de ayuda. Si la serología se realiza en este entorno, sugerimos una prueba de IgG. En muchos casos, debido a la disponibilidad limitada de pruebas y la preocupación por los resultados falsos negativos, el diagnóstico de COVID-19 se hace presuntamente basado en una presentación clínica compatible en el contexto de un riesgo de exposición en ausencia de otras causas identificables.
Conflicto de interés
Ninguno que declarar.
Aspectos éticos
Este trabajo es parte del proyecto que fue aprobado por el Comité Expedito de la Coordinación General para el Desarrollo Estratégico en Salud del Ministerio de Salud Pública del Ecuador según lo estipulado por la Resolución N ° 054-2020 y por la Subdirección de Docencia e Investigación del Hospital General del Sur de Quito.
Financiación
El estudio no requirió fuentes de financiamiento.
Contribución de los autores
Diseño del trabajo: FXM, JZ y CZ
Recolección/obtención de resultados: HRE, MAB, CA, JE
Parte técnica y pruebas de laboratorio: PG, GS, MAB, CA
Análisis e interpretación de datos: CZ, JZ, FXM
Redacción del manuscrito: CZ, JZ
ANEXOS
REFERENCIAS BIBLIOGRÁFICAS
Zurita-Salinas C, Mora F, Espejo H, Bonifaz M, Sevillano G, González-Andrade P, Aguilera C, Escobar J, Zurita J. Falla en la detección de SARS-CoV-2 mediante qRT-PCR en pacientes hospitalizados con COVID-19. Metro Ciencia [Internet]. 29 de abril de 2021; 29(2):23-31. https://doi.org/10.47464/MetroCiencia/vol29/2/2021/23-31